Простые эфиры целлюлозы. Способ получения пластифицированной нитроцеллюлозы
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
8. Окисление целлюлозы. Реакции избирательного окисления
Окисление целлюлозы - одна из важнейших ее реакций, представляющая большой теоретический и практический интерес. Реакции окисления имеют место при отбелке и облагораживании целлюлозы, при получении медноаммиачного волокна, при предсозревании щелочной целлюлозы в производстве вискозного волокна и простых эфиров целлюлозы, а так же в ряде производств целлюлозно-бумажной и текстильной промышленности.
В процессе окисления в макромолекулу целлюлозы вводятся новые функциональные группы, главным образом карбонильные и карбоксильные, в результате чего целлюлоза приобретает ряд новых свойств, одни из которых являются нежелательными, а другие, наоборот, могут представлять практический и научный интерес.
Целлюлоза очень чувствительна к действию окислителей из-за наличия в каждом элементарном звене трех спиртовых гидроксильных групп. Поэтому практически любой образец выделенной из растительных тканей целлюлозы содержит в небольшом количестве карбонильные и карбоксильные группы. У древесной целлюлозы содержание этих групп выше, чем у хлопковой.
В большинстве случаев процесс окисления гидроксильных групп сопровождается одновременным снижением СП целлюлозы за счет деструкции. Однако известен ряд методов получения окисленной целлюлозы, при которых деструкции не происходит. В соответствии с этим у целлюлозы, как и у других ВМС, различают чисто окислительные реакции функциональных групп и окислительно-гидролитические реакции (окислительная деструкция). Степень окислительной деструкции целлюлозы зависит от природы окислителей и условий окисления. Окислительная деструкция обычно является нежелательной реакцией, однако в некоторых случаях ее проводят преднамеренно. Например, окисление целлюлозы молекулярным кислородом в присутствии щелочи в основе процесса предсозревания щелочной целлюлозы и служит средством регулирования степени полимеризации целлюлозы в вискозном волокне.
Окисление целлюлозы может проводиться в гомогенной и гетерогенной средах. Окисление в гомогенной среде протекает, например, в медноаммиачном растворе целлюлозы под действием кислорода. В большинстве случаев окисление целлюлозы идет гетерогенно. Ход такого окисления зависитот надмолекулярной структуры целлюлозы (плотности упаковки) и морфологического строения волокна. Реакция окисления начинается с поверхности, затем происходит и внутри волокна, при этом постепенно разрушаются его концентрические слои. Сначала окисляется аморфная часть целлюлозы, а затем уже плотно упакованные кристаллические участки. В результате окисления механическая область волокна постепенно понижается, оно становится ломким. Продукты начального окисления еще сохраняют волокнистую структуру, но после глубокого окисления целлюлоза может даже растираться в порошок.
В процессе окисления продукты начального окисления целлюлозы удерживаются на ее поверхности, такая целлюлоза называется оксицеллюлозой, которая представляет смесь природной целлюлозы с продуктами окисления.
Процесс окисления целлюлозных молекул протекает в несколько стадий. В начальной стадии происходит частичное окисление спиртовых групп целлюлозы, а затем происходит деструкция цепных молекул. При более интенсивном окислении образуются низкомолекулярные моно- и дикарбоновые оксикислоты. Например, из растворимых в воде продуктов глубокого окисления целлюлозы были выделены глюкуроновая кислота и другие оксикислоты, например изосахариновая
OH - CHOH - - C(OH) - COOH,
диоксимасляная COOH а также щавельная
При полном окислении целлюлозы образуются углекислый газ и вода:
Вследствие ложного характера процесса окисления продукты окисления целлюлозы химически и физически неоднородны.
Известны три реакции избирательного окисления целлюлозы: 1) окисление альдегидных групп; 2) окисление первичных спиртовых гидроксилов; 3) окисление вторичных спиртовых гидроксилов с разрывом связи - .
Реакция избирательного окисления альдегидных групп и окисление целлюлозы гипохлоритом. Хлористая кислота, ее соли - хлориты и двуокись хлора, будучи очень мягкими окислителями, окисляют главным образом концевые альдегидные группы в карбоксильные. Гидроксильные группы при этом мало затрагиваются. В результате такого окисления получается глюконовокислая оксицеллюлоза.
В отличие от хлористой кислоты хлорноватистая кислота HCIO действует на целлюлозу не избирательно. Эта реакция имеет большое практическое значение, так как соли HCIO - гипохлориты являются основными реагентами, используемыми для отбелки целлюлозы. Как уже говорилось, характер и скорость реакций окисления целлюлозы гипохлоритами определяются pH среды. В среде близкой к нейтральной (рН 6-8) в растворе находится и HCIO и ионы CIO-. Скорость окисления в этих условиях наибольшая, а получающаяся оксицеллюлоза обладает как кислотными, так и восстанавливающими свойствами. Наиболее мягко гипохлориты действуют в щелочной среде. В кислотной и нейтральной средах, кроме окисления концевых альдегидных групп, протекают две реакции:
1) окисление первичных спиртовых гидроксильных групп у 6-го атома С до альдегидных групп и в незначительное степени - до карбоксильных групп.
2. Образование -оксикетона за счет окисления вторичного спиртового гидроксила у 2-го атома С:
В щелочной среде окисление начинается с тех же реакций образования альдегидной группы у 6-го С и -кетона, но в щелочной среде окисление обязательно продолжается дальше до образования СООН-групп:
При отбелке гипохлоритам стремятся проводить процесс так, чтобы свести к минимуму окислительную деструкцию. Однако даже в таких случаях в некоторой степени происходит деструкция целлюлозы - снижаются ее вязкость и механические свойства Этих недостатков лишены более мягкие отбеливающие реагенты - двуокись хлора и хлорит натрия. При обработки двуокисью хлора вязкость растворов целлюлозы и ее механические свойства почти не снижаются. Аналогично двуокиси хлора действуют на целлюлозу соли хлористой кислоты - хлориты.
2.Окисление первичных спиртовых гидроксилов.Второй тип оксицеллюлозы получается при действии на целлюлозу двуокиси азота. Последняя так же является более или менее специфическим реагентом, способным окислять первичные гидроксильные группы до карбоксильных:
Продукт реакции носит название монокарбоксилцеллюлозы. Окисление может осуществляться действием на целлюлозу газообразной двуокиси азота, жидкого азотноватого ангидрида или его раствора в. Реакция окисления идет по уравнению
R - OH + > R - COOH + 2NO + O.
Степень окисления зависит от продолжительности реакции, температуры и количества. При полном окислении всех первичных спиртовых групп содержание СООН-групп в окисленной целлюлозе составляет примерно 25%. На практике получают оксицеллюлозы с меньшим содержанием СООН-групп. Эти продукты окисления по строению близки к полиглюкуроновой кислоте и поэтому по свойствам они напоминают пектиновые вещества. В настоящее время их применяют в текстильной и других отраслях промышленности, а так же в медицине как кровоостанавливающее средство.
Оксицеллюлоза, полученная при окислении целлюлозы двуокисью азота, при содержании свыше 13% СООН-групп (т. е. при окислении более половины первичных спиртовых групп) способна полностью растворяться в разбавленной щелочи (2%-ной NaOH), аммиаке и соде.
Присутствие СООН-групп у 6-го атома С (даже в очень небольшом количестве) резко снижает устойчивость целлюлозы к действию щелочей и даже воды при повышенной температуре по сравнению с природной целлюлозой, которая очень медленно реагирует со щелочами. Например, хлопчатобумажная ткань, содержащая 2-3% СООН-групп у 6-го атома С, после кипячения с водой полностью рассыпается в порошок. Следует заметить, что введение такого же количества карбоксилов у 2-го и 3-го атомов С с получением дикарбоксилцеллюлозы почти не влияет на прочность целлюлозных тканей.
Необходимо указать, что медноаммиачный способ определения СП не пригоден для целлюлозы, окисленный двуокисью азота, даже при содержании СООН-групп около 2,5%, так как в процессе определения вязкости будет происходить деструкция.
Следует также отметить, что при окислении целлюлозы двуокисью азота окисление первичных спиртовых групп всегда сопровождается окислением вторичных спиртовых групп.
3. Окисление вторичных спиртовых гидроксилов с разрывом связи -. Иодная кислота является специфическим окислителем, действующим на гликолевую группировку (- СНОН - СНОН -), окисление которой идет по схеме
т. е. иодная кислота является специфическим окислителем для вторичных гидроксилов целлюлозы.
В результате подобной реакции при окислении целлюлозы иодной кислотой (периодатами в кислой среде) получается периодатная оксицеллюлоза, или диальдегидцеллюлоза:
Однако, как показали спектроскопические и химические исследования, иодная кислота окисляет частично и первичные гидроксиды у 6-го углеродного атома.
Наличие в периодатной иксицеллюлозы многочисленных альдегидных групп делает ее очень неустойчивой к действию щелочей. Даже после сравнительно мягкой щелочной обработки вязкость медноаммиачного раствора и прочность волокна заметно снижаются.
Диальдегидцеллюлоза при действии на ней хлорита натрия и двуокиси хлора, окисляющих альдегидные группы, превращается в дикарбоксилцеллюлозу.
При последовательном окислении целлюлозы периодатом, хлоритом и двуокисью азота получается трикарбоксилцеллюлоза, содержащая до 50,8% СООН-групп
При восстановлении диальдегидцеллюлозы боргидридом натрия альдегидные группы восстанавливаются до спиртовых. Полученный препарат иногда называют диалкогольцеллюлозой. Она содержит в элементарном звене три первичные спиртовые группы:
Такую обработку используют иногда для борьбы с пожелтением (реверсией белезны) беленой целлюлозы.
Наличие в макромолекуле целлюлозы новых функциональных групп (например, альдегидных) дает возможность осуществлять новые химические превращения. Открываются перспективы для синтеза новых производных целлюлозы (так называемой модификацией целлюлозы).
Приведенные три метода окисления спиртовых групп целлюлозы исчерпывают известные в настоящее время возможности избирательного окисления целлюлозы. Все остальные окислители приводят к реакциям окисления, идущим сразу в нескольких направлениях.
9. Нитраты целлюлозы, из получение, свойства и применение
Нитраты целлюлозы, или азотнокислые эфиры целлюлозы, часто называют нитроцеллюлозой. Это название неправильно, так как эти продукты являются сложными эфирами целлюлозы и азотной кислоты, а не нитросоединениями. Поэтому термин «нитроцеллюлоза» следует рассматривать как чисто технический, хотя им пользуются широко в литературе.
Реакцию нитрования целлюлозы с азотной кислотой можно представить следующим образом:
Эта реакция обратима. Устанавливается равновесие между целлюлозой (как спиртом), азотной кислотой, сложным эфиром и водой. Содержание воды в реакционной смеси является основным условием, определяющим состояние конечного равновесия.
Нитрование обычно проводят в присутствии водоотнимающих средств, в качестве которых в промышленности применяют серную кислоту, а в лабораторной практике также уксусный или фосфорный ангидрид (в смеси с уксусной или фосфорной кислотой). Нитрование целлюлозы тройными смесями - - Oявляется основой промышленного способа производства нитратов целлюлозы.
Теоритически содержание азота в тринитрате целлюлозы составляет 14,14%. В динитрате целлюлозы содержится 11,1%N, в мононитрате 6,8% N. Практически при нитровании смесями - - Oполучить нитрат не удается. Наивысшая достигаемая степень нитрования оставляет примерно 13,8% азота.
Степень замещения нитрата целлюлозы при нитровании такой тройной смесью зависит главным образом от содержания воды в смеси. Чем выше процент воды в смеси, тем ниже окажется процент азота в конечном продукте, причем, как показали многочисленные исследования, степень замещения полученного нитрата целлюлозы, в следовательно, и его свойства зависят не от начального состава смеси, а от состава смеси в конце нитрования. Конечный состав смеси зависит в свою очередь от выделения воды при реакции, а также от влажности целлюлозы, степени поглощения влаги из воздуха и т.д.
Для уменьшения влияния фактора разбавления смеси процесс ведется при большом избытке нитрующей смеси. Соотношение между массой целлюлозы и массой нитрующей смеси называют модулем ванны Обычно применяют модуль около 1: 50.
Влияние состава нитрующих смесей на содержание азота в нитрате целлюлозы изучалось с помощью диаграмм тройных смесей. Эти диаграммы показывают, что нитроцеллюлозы с одним и тем же процентом N (и с одной и той же вязкостью), могут быть получены при различном соотношении и, но при одном и том де содержании воды в смеси. Однако, как показывают диаграммы, для технического нитрования пригодными могут быть не любые смеси. В некоторых смесях может наблюдаться растворение и деструкция целлюлозы или слишком сильное набухание.
Серная кислота, входящая в состав нитрующей смеси, связывая выделяющуюся воду при реакции, сдвигает ее равновесие в право. Иначе говоря, регулирует количество свободной воды в смеси. Так как теплота гидратации серной кислоты более высокая, чем азотной (для моногидрата примерно в 5 раз), в смеси должны присутствовать гидраты серной кислоты, а не азотной. По-видимому, это способствует переходу азотной кислоты в безводную псевдоформу - OH, которая и участвует в реакции этерификации целлюлозы. Вода, наоборот, способствует переходу в гидратированную ионную форму:
Механизм нитрования можно представить следующим образом. Сначала происходит протонирование азотной кислоты с образованием иона нитрония:
H нитроний
Затем осуществляется электофильная атака ионом нитрония кислорода OH-группы целлюлозы с отщеплением протона и образованием нитрата
Если в нитрующей смеси содержится мало воды и и много, в этой зоне идет деструкция целлюлозы, а не нитрование. При более высоком содержании воды (более 12%) ионы нитрония отсутствуют, вода распределяется между и и с увеличением воды, т. е. с увеличением степени гидратации степень замещения падает.
Скорость реакций нитрования зависит от соотношения в смеси между азотной и серной кислотами. Увеличение содержания с параллельным уменьшением содержания сверх определенного предела понижает скорость реакции и приводит к деструкции целлюлозы. При слишком высоком содержании целлюлоза растворяется в нитрующей смеси и далее гидролизуется. Однако необходимо поддерживать в смеси такое количество серной кислоты, при котором достигается хорошее набухание целлюлозы, облегчающее доступ внутрь волокна тем самым повышающее скорость процесса. Реакция становится пермутоидной. Поэтому подбирают оптимальное соотношение азотной и серной кислот, учитывая при этом также меньшую стоимость. Обычно в практике используют отношение к около 1: 3.
При получении нитратов целлюлозы происходят побочные реакции: окислительная и гидролитическая деструкция, а также образуются частично замещенные сернокислые эфиры (сульфаты) целлюлозы:
(OH) + > (OH) + O.
Образование смешанных сернокислых и азотнокислых эфиров объясняет невозможность практически достичь теоретического содержания азота, соответствующего тринитрату целлюлозы. Присутствие сернокислых эфиров (очень нестойких) уменьшает устойчивость (стабильность) нитратов целлюлозы. Нитраты целлюлозы уже при умеренных температурах самопроизвольно разлагаются. Скорость разложения быстро растет с повышением температуры и резко возрастает в присутствии примесей кислот, щелочей и др. Разложение нитратов целлюлозы - самоускоряющийся процесс, который, особенно в присутствии влаги и кислорода, может закончиться вспышкой и взрывом. Это вызывает необходимость стабилизации полученного нитрата целлюлозы, который для этого ромывают горячей водой, разбавленный кислотами, 0,2-1%-ным раствором соды и т. д. Сернокислые эфиры при этом гидролизуются (омыляются)
Повышение температуры увеличивает скорость процесса нитрования, не влияя на состояние равновесия. Однако при этом возрастают и скорости побочных процессов - окислительной и гидролитической деструкции. Та, при температуре 15-20° С распад азотной кислоты происходит в очень слабой степени и реакции окисления почти не идут. При температуре выше 40°С происходят бурный распад азотной кислоты с выделением окислов азота и сильная окислительная деструкция целлюлозы. Увеличение температуры способствует и гидролитической деструкции целлюлозы, особенно при одновременном повышении содержания воды в кислотной смеси. Вода повышает степень ионизации и, следовательно, гидролизующее действие кислот, особенно.
Влияние продолжительности реакции на процесс подобно влиянию температуры. Так как реакция нитрования идет быстро, процесс осуществляют в течение 30 мин - 1 ч. Дальнейшее увеличение продолжительности способствует гидролитической деструкции целлюлозы.
Вследствие отрицательного влияния на процесс нитрования (образование сульфатов, гидролитическая деструкция) в некоторых случаях ее заменяют другими водоотнимающими агентами. В лабораторной практике обычно применяют смесь азотной, фосфорной кислот и фосфорного ангидрида или азотной, уксусной кислот и уксусного ангидрида. В этих случаях нитрование протекает почти в безводной среде, оно идет более полно (получаются тринитраты почти с теоретическим содержанием азота) и практически отсутствует деструкция целлюлозы. Нитраты, полученные таким способом, используются для определения СП целлюлозы и ее фракционирования.
При нитровании с применением иногда используют разбавители - инертные органические растворители, например хлорированные углеводороды. Можно также проводить нитрование азотной кислотой в присутствии ее солей. Иногда вместо азотной кислоты применяют другие нитрующие агенты, например ангидрид азотной кислоты.
Технические процесс получения нитратов целлюлозы состоит из следующих операций: измельчения и сушки целлюлозы; нитрования смесью кислот (состав смеси подбирается в зависимости от назначения конечного продукта); удаления отработанной смеси центрифугированием; стабилизации; регулирования вязкости конечного продукта (снижением СП способом гидролиза); вытеснения воды этиловым спиртом.
Нитраты целлюлозы хранят в увлажненном спиртом состоянии.
Древесная целлюлоза содержит примеси (лигнин и гемицеллюлозы), которые отрицательно влияют на качество продукта. Нитрат целлюлозы получается неоднородным и нестойким. Азотнокислые эфиры из хлопковой целлюлозы получаются более стойкими и имеют большую вязкость, чем эфиры из древесной сульфитной целлюлозы.
Сульфитную целлюлозу, предназначенную для переработки на нитраты целлюлозы, следует белить осторожно, чтобы не снизить значительно вязкость. После отбелки обязательно необходимо облагораживание. Облагороженная целлюлозы содержит не менее 65% альфа-целлюлозы.
При производстве нитратов целлюлозы выполняют ряд анализов. Определяют процентное содержание азота (способом Лунге). По процентному содержанию [N] рассчитывают степень замещения СЗ.
Анализ основан на омылении нитрата целлюлозы серной кислотой в присутствии ртути, восстанавливающей образующуюся азотную кислоту до окиси азота, объем которой измеряют.
6Hg > 2NO + + O.
Определяют скорость нитрата целлюлозы при различной температуре, вязкость и СП, температуру вспышки и растворимость в различных растворителях.
Свойства нитратов целлюлозы и их применение
Различаются следующие основные виды технических нитратов целлюлозы, которые в зависимости от СЗ и СП находят различное практическое применение: коллоксилин (10,7-12,5% N), пироколлодий (12±0,1% N), пироксилин №2 (12,2-12,5% N), пироксилин №1 (13,0-13,5% N).
Нитраты целлюлозы, содержащие 9-11% N, растворяются в этиловом спирте, нитраты с содержанием до 13% - в смеси этилового спирта и эфира. Все нитраты целлюлозы растворяются в ацетоне. Нитраты целлюлозы любой степени замещения не растворяются в воду и неполярных растворителях (например бензоле).
Коллоксилин применяют для производства этрола, целлулоида и лаков. Коллоксилин целлулоидных марок имеет СП 400-600, а лаковых марок - 150- 300. Коллоксилин не устойчив к действию кислот и щелочей. Разбавленные минеральные кислоты вызывают медленную денитрацию коллоксилина. Концентрированная серная кислота растворяет коллоксилин. Коллоксилин растворяется в кетонах (ацетон), сложных эфирах (этилацетат, бутилацетати др.), фурфуроле, диоксане и уксусной кислоте; устойчив к действию ароматических и алифатических углеводородов и масел. Из высококипящих растворителей, применяемых в качестве пластификаторов, коллоксилин растворяется в камфаре, эфирах фталевой кислоты и др. Этрольные и целлулоидный коллоксилины с содержанием азота 10,9-11,2% растворяются в спиртово-камфарных смесях. Коллоксилин с содержанием азота 11,2-12,5%, предназначенный для изготовления нитролаков, нитроэмалей и нитромастик, растворяется в смеси растворителей.
Фракционный состав нитратов целлюлозы влияет на их стабильность, механические свойства пленок и т. п. Основным их недостатком является горючесть и легкая воспламеняемость.
Целлулоид представляет собой пластическую массу, состоящею из коллоксилина, пластификатора (камфары), добавок (напрмер, фосфорнокислого натрия), пигментов и красителей. По существу это твердый раствор нитрата целлюлозы в камфаре. Широко применяется для изготовления галантерейных изделий, игрушек, для отделки музыкальных инструментов, изготовления оправ для очков и др.
Этрол представляет собой термопластичный материал, получаемый на основе пластифицированного нитрата целлюлозы с минеральными и органическими наполнителями. Из него изготовляют рулевые колеса, рычаги переключения передач, приборные щитки, детали холодильников, электроизоляционные детали изделий ширпотреба.
Пироксилин (СП 1000-2000) применяется для производства взрывчатых веществ и порохов. Различают три вида порохов, получаемых на основе нитратов целлюлозы: пироксилиновые (температура горения около 2500°С), баллиститные и кордитные. Два последних вида называют также нитроглицериновыми (температура горения около 3500°С).
При получении порохов применяют желатинирующие добавки (смесь этилового спирта и диэтилового эфира, нитроглицерин и другие органические растворители), стабилизаторы (например, дефениламин), флегматизаторы (камфара). Для изготовления баллиститных порохов применяют коллоксилин с высоким содержанием азота (11,5-12,2%).
10. Пентозаны и их определение. Основные представители
Пентозаны - это полисахариды, главными звеньями макромолекулы которых являются звенья пентоз. Упрощенная эмпирическая формула пентозанов (С5Н8О4)n. Цепи пентозанов значительно короче, чем цепи целлюлозы.
Из пентозанов наиболее распространены и более изучены ксиланы, дающие при гидролизе в качестве основного моносахарида Л-ксилозу. В меньших количествах в древесине содержится арабинан, который дает при гидролизе L-арабинозу. Арабинан древесины пока еще мало изучен. Арабинан гидролизуется легко. Часть же ксилана древесины гидролизуется только вместе с целлюлозой, с которой он совместно ориентирован.
Пентозаны, главным образом ксиланы, широко распространены в природе и встречаются во всех древесных породах. В древесине лиственных пород пентозанов значительно больше (20--25%), чем в древесине хвойных (9--11%).
|
Наименование |
Хвойная древесина |
Наименование |
Лиственная древесина |
||
|
Лиственница сибирская |
|||||
|
Кедр сибирский |
В древесине пентозаны распределены неравномерно: в ветвях их больше, чем в стволе.
Различные сельскохозяйственные отходы содержат довольно значительное количество пентозан. Так, в кукурузной кочерыжке их содержится до 39,5% в подсолнечной лузге и хлопковой шелухе - 23-35%. Эти отходы в случае их технического использования могут быть хорошим источником для получения пентозанов.
Наряду с пентозами в растительном сырье найдено также небольшое количество метилпентозанов. , которые при гидролизе дают метилпентозы С5Н9О5СН3. Хвойные породы могут содержать до 3% метилпентозанов, в лиственной древесине их или нет, или не более 1 %.
О содержании пентозанов в том или ином растительном материале судят по сахарам, получающимся при гидролизе. Сахара определяют в виде характерных производных, например гидразонов, или хроматографически. Метод хроматографии применяют в том случае, если нужно знать состав и количественное соотношение различных полисахаридов в анализируемом материале. Чаще определяют суммарное содержание пентозанов, подвергая их гидролизу до пентоз с последующим образованием из них фурфурола.
В дистилляте количественно определяется фурфурол весовыми, объемными, колориметрическим или спектрофотометрическим методами. Так как при перегонке часть фурфурола осмоляется и разлагается, выход его не соответствует теоретическому. Поэтому для пересчета найденного количества фурфурола на пентозаны применяются эмпирические коэффициенты, составленные на основании опытных данных.
Определение пентозанов этим способом, однако, не является вполне точным. Метилпентозы, образующиеся при гидролизе, при нагревании с 12%-ной HCl, как и пентозы, отщепляют воду и превращаются в метилфурфурол, способный реагировать подобно фурфуролу
Оксиметилфурфурол не стоек и в присутствии HClбольшая часть его разлагается на муравьиную и левулиновую кислоты:
Однако часть оксиметилфурфурола все же переходит в дистиллят и реагирует подобно фурфуролу.
Входящие в состав гемицеллюлоз древесины уроновые кислоты также дают при перегонке с 12%-ной HClнекоторое количество фурфурола по схеме:
Вследствие этого в результаты определения пентозанов следовало бы вносить поправку на содержание уроновых кислот. Однако считают, что выход фурфурола из уроновых кислот составляет только 1/3 -- 1/2 от теоретического, и, поскольку содержание уроновых кислот в древесине невелико, поправку в расчеты обычно не вносят.
Несмотря на многочисленные исследования, посвященные разработке надежного метода определения фурфурола в дистилляте, ни один из существующих методов не является абсолютно точным.
Наиболее распространенными весовыми методами являются методы осаждения фурфурола флороглюцином, барбитуровой и тиобарбитуровой кислотами.
Осаждение фурфурола флороглюцином происходит по схеме:
С5Н4О2 + С6Н6О3 > Н2О + С12Н8О4
Флороглюцин фурфурола
Метилфурфурол и оксиметилфурфурол также конденсируются с флороглюцином, давая осадки, поэтому результаты получаются завышенными. Однако флороглюцид метилфурфурола растворяется в этиловом спирте. Пользуясь этим его свойством, можно отделить флороглюцид метилфурфурола и определить количественно содержание метилпентозанов.
Осаждение фурфурола с барбитуровой кислотой идет по схеме:
Преимуществом применения барбитуровой кислоты является то, что она не осаждает оксиметилфурфурола.
Еще лучше осаждать фурфурол тиобарбитуровой кислотой:
Объемные методы несколько менее точны, чем весовые, но выполняются они значительно быстрее. Наиболее распространен бромный (бромид-броматный) метод, основанный на способности фурфурола при действии раствора NaBr и NaBrO3 в присутствии HClреагировать с образующимся бромом:
5NaBr + NaBrO3 + 6HCl = 3Br2 + 6NaCl + 3H2O
Механизм реакции фурфурола с бромом окончательно еще не изучен. Считают, что в течение 1 ч с одной молекулой фурфурола реагируют четыре атома брома. Предполагают, что эта реакция идет в две стадии. В первой стадии фурфурол окисляется с образованием пирослизевой кислоты.
Этот процесс идет в течение 5 мин. Во второй стадии (в последующие 55 мин) вступает в реакцию еще одна молекула брома, причем бром частично присоединяется к пирослизевой кислоте и частично замещает водород в фурановом кольце.
В последнее время нашли применение колориметрические методы определения фурфурола, основанные на его цветных реакциях, например с орсином (4-метилрезорцином) и уксуснокислым анилином, а также спектрофотометрические методы, основанные на измерении УФ-поглощения фурфурола.
Из пентозанов наиболее широкое распространение вприроде получил ксилан, который входит в сосьав большинства растительных материалов и встречается во всех породах древесины.
Ксиланы различных растительных материалов несколько отличаются друг от друга составом и строением. В главную цепь ксиланов входят звенья в-D-ксилопиранозы, соединенные глюкозидной связью по месту 1--4. Все встречающиеся в природе ксиланы не имеют простого строения, они всегда разветвлены, причем, как правило, кроме звеньев ксилозы содержат звенья других сахаров и в том числе уроновых кислот. Истинный ксилан найден лишь в траве эспарто и в водорослях.
В лиственной древесине содержится глюкуроноксилан. Его цепь сильно разветвлена и связана с остатками 4-метил-D-глюкуроновой кислоты б-гликозидной связью 1--2 (или 1--3). В хвойной древесине содержится арабиноглюкуроноксилан, у которого в качестве боковых ответвлений у некоторых звеньев имеются остатки 4-метил-D-глюкуроновой кислоты в положении 2, а у других звеньев остатки L-арабинозы в положении 3 (по-видимому, в б-форме).
Ксиланы хвойной древесины содержат в среднем одно звено глюкуроновой кислоты на 5--9 звеньев ксилозы (15--20%), а ксиланы лиственной древесины -- одно звено на 9--11 звеньев ксилозы (8--15%). Распределение боковых ответвлений глюкуроновой кислоты хаотическое, причем наряду с метилированной глюкуроновой кислотой содержится и неметилированная. Содержание звеньев арабинозы в хвойных ксиланах соответствует примерно одному звену на 7--9 звеньев ксилозы. Иногда встречаются боковые ответвления ксилозы (связь 1--3).
В состав лиственных ксиланов входят ацетильные группы ОСОСН3. Так, в ксилане березы примерно семь остатков ксилозы из десяти имеют ацетильную группу в положении 3. Ксиланы хвойных, по-видимому, не ацетилированы.Боковые звенья уроновой кислоты влияют на устойчивость связей между звеньями ксилозы в главной цепи -- повышают устойчивость глюкозидной связи, соединяющей звено, содержащее боковое ответвление уроновой кислоты, с соседним звеном, вследствие пространственных затруднений.
Ксилан из древесины выделяют щелочью. При обработке древесины лиственных пород 4%-ным раствором NаОН в раствор переходит главным образом ксилан, а также небольшое количество арабинана и гексозанов. Из щелочного раствора после подкисления сырой ксилан осаждают спиртом. Однако такой ксилан содержит примеси других гемицеллюлоз. Чистый ксилан получают через меднощелочное соединение. Из щелочного раствора ксилан осаждают фелинговой жидкостью, при этом выделяется осадок меднощелочных соединений пентозанов. Этот осадок суснендируют в спирте и для разложения меднощелочных соединений через суспензию пропускают газообразный НСl. Выделившиеся свободные пентозаны состоят главным образом из ксилана с примесью арабинана, который удаляют промывкой водой. Полученный сравнительно чистый ксилаи промывают спиртом.
Ксилан представляет собой белый аморфный порошок, растворимый в щелочи, сильно набухающий в воде, но нерастворимый в спирте и других органических растворителях. Выделенные препараты ксилана содержат 1-1,5% метоксильных групп и 2% карбоксильных. Содержание этих групп в ксилане зависит от способов выделения и тщательности очистки препаратов. Степнь полимеризации ксилана, определенная осмотическим методом, составляет 120 -150, вискозиметрическим способом - около100.
Замечено, что даже в одной и той же древесине ксилан не однороден по своему составу и может состоять из фракций различного состава. Степень полимеризации ксиланов в среднем около 200 (колеблется от 70 до 260).
В последнее время были обнаружены ксиланы (глюкуроноксиланы), образующие кристаллические структуры, причем установлено, что с увеличением содержания звеньев глюкуроновой кислоты степень кристалличности уменьшается. Из некоторых растительных тканей (камыш, береза) удалось выделить кристаллы ксилана и на основании рентгенографических исследований установить параметры элементарной кристаллической ячейки.
Ксилан из древесины выделяют щелочью. При обработке древесины лиственных пород 4%-ным раствором NаОН в раствор переходит главным образом ксилан, а также небольшое количество арабинана и гексозанов. Из щелочного раствора после подкисления сырой ксилан осаждают спиртом. Однако такой ксилан содержит примеси других гемицеллюлоз. Чистый ксилан получают через меднощелочное соединение. Из щелочного раствора ксилан осаждают фелинговой жидкостью, при этом выделяется осадок меднощелочных соединений пентозанов. Этот осадок суснендируют в спирте и для разложения меднощелочных соединений через суспензию пропускают газообразный НСl. Выделившиеся свободные пентозаны состоят главным образом из ксилана с примесью арабинана, который удаляют промывкой водой. Полученный сравнительно чистый ксилан промывают спиртом.
Выделенные препараты ксилана содержат 1-1,5% метоксильных групп и 2% карбоксильных. Содержание этих групп в ксилане зависит от способов выделения и тщательности очистки препаратов. Степнь полимеризации ксилана, определенная осмотическим методом, составляет 120 -150, вискозиметрическим способом - около100.
Ксилан относится к широко распространенным в природе полисахаридам. На каждый остаток C5H8O4 в молекуле ксилана приходится две спиртовые гидроксильные группы. Эти гироксо группы и определяют в значительной степени свойства ксилана.Получены нитроксиланы, содержащие полторы - две нитрогруппы на каждые 5 атомов углерода. При метилировании ксилана диметилсульфатом в щелочной среде образуется простой эфир ксилана, содержащий две метоксильные группы на один остаток C5H8O4.Метилированные ксиланы подобно метилированной целлюлозе хорошо растворяются в холодной воде, а также в хлороформе, ацетоне и других органических растворителях. Получены, но недостаточно изучены эфиры ксилана и ряда органических кислот. Эти эфиры получаются при обработке ксилана хлорангидридами соответствующих кислот в присутствии щелочи. При действии концентрированных кислот ксилан разрушается и образуются смолообразные продукты неизвестного строения.
Ксилан наряду с целлюлозой служит источником ценных продуктов, получаемых из растительного сырья в гидролизном производстве.
Арабинан
Арабинан широко распространен в природе. Он входит в состав пектиновых веществ различных плодов и корнеплодов. Арабиноза также часто входит в состав молекул других полисахаридов.
При гидролизе древесины в продуктах гидролиза находят арабинозу, которая частично получается из полисахарида -- арабинана, построенного из звеньев арабинозы, и частично из смешанных полисахаридов -- арабиноглюкуроноксилана н арабиногалактана; содержание арабинозы в продуктах гидролиза невелико (для хвойных пород древесины 1 --1,9%, для лиственных до 4,2%). Вся арабиноза практически содержится в продуктах гидролиза легкогидролизуемой части древесины.
В чистом виде арабинан был выделен из пектинов яблока, земляного ореха, сахарной свеклы и в небольшом количестве из древесины одного из видов сосны. Арабинан -- белый порошок, растворимый в щелочи и в воде, не растворимый в спирте. Арабинан очень гигроскопичен. Молекулярная масса арабинана, по-видимому, невысока, так как степень полимеризации арабинана сахарной свеклы колеблется в среднем от 40 до 50.
Строение арабинана окончательно не выяснено. Считают, что его цепная молекула состоит из звеньев б-L-арабинофуранозы, связанных в положении 1--5. Часть таких единиц имеет в качестве боковых ответвлений
дополнительные остатки б-L-арабинозы, связанные связями 1-3 и 1-2.
Химические свойства арабинана мало исследованы. Из производных арабинана известен диметиларабинан, который был получен с целью изучения структуры арабинана. Известно также, что арабинан со щелочью образует химическое соединение подобно целлюлозе.
11.Общее понятия о лигнине и его структурных единицах. С вязь лигнина с углеводами
Лигнин -- это ароматическая часть древесины, не способная к гидролизу минеральными кислотами. Она наименее изучена. Точное строение лигнина еще не известно, несмотря на то, что он был открыт свыше 130 лет назад. Однако за последние 20--30 лет в химии лигнина достигнуты значительные успехи: установлены элементарные звенья лигнина, его характерные функциональные группы, основные типы связей между элементарными звеньями и структуры, присутствующие в макромолекулах лигнина.Лигнин представляет собой смесь нерегулярных разветвленных полимеров родственного строения, в основе которых лежат близкие по строению ароматические вещества. Макромолекулы лигнина построены из фенилпропановых структурных единиц С6--С3
В хвойном лигнине эти единицы являются производными пирокатехина (гваяцилпропановые единицы I), а в лигнине лиственных пород, кроме того, содержатся производные пирогаллола (сирингилиропановые единицы II).
В состав некоторых лигнинов, главным образом травянистых растений, а иногда хвойной древесины входят единицы, не содержащие метоксильных групп (III).
При мягком окислении нитробензолом в щелочной среде из лигнина хвойных пород получается ванилин, а из лигнина лиственных пород -- смесь ванилина и сиреневого альдегида. Единицы типа III при нитробензольном окислении дают п-оксибензальдегид.
Пропановые боковые цепи структурных единиц могут иметь различное строение (в зависимости от содержащихся в них функциональных групп). Таким образом, любой лигнин является сополимером. Лигнины лиственных пород древесины имеют более сложное строение, чем хвойных. Следует отметить, что структура макромолекул лигнина лишена регулярности, характерной для многих других природных полимеров.
В отличие от полисахаридов в лигнине отсутствует единый вид связи между структурными единицами. Наоборот, для него характерно многообразие связей, в результате чего он имеет макромолекулы с высокой степенью разветвленности. Предполагают, что лигнин в древесине является пространственным полимером, т. е. имеет сетчатую структуру.
Лигнин древесины почти полностью не растворим в известных растворителях, не гидролизуется кислотами до мономерных единиц, очень чувствителен даже к мягким обработкам и поэтому значительно изменяется при выделении. Все это является препятствием для его изучения.
В древесине хвойных пород содержится до 28--30% лигнина, а в древесине лиственных пород 18--24%.
Типы связей лигнина с углеводами
Лигнин очень рано образуется в растительных клетках. Впервые дни после образования клетки и отделения ее от камбия клеточная стенка еще не содержит лигнина. Через небольшой промежуток времени (у некоторых растений даже на второй-третий день) клеточные стенки начинают давать качественную реакцию на лигнин -- красное окрашивание с солянокислым флороглюцином.
Процесс лигнификации (одревеснение) приводит к изменению механических свойств клеточных стенок. Растительная ткань становится более прочной и устойчивой, более гидрофобной.
Возникновение лигнина в природе, как показало изучение химического состава растений во взаимосвязи с их эволюцией, в определенной мере обусловлено переходом растительных организмов от водного к наземному образу жизни.
Процесс одревеснения сопровождается накоплением мето-ксильных групп в лигнине.
В клеточной стенке сложная срединная пластинка имеет высокое содержание лигнина, но большая его часть находится во вторичной стенке (слое). Окончание процесса лигнификации обычно совпадает с прекращением жизнедеятельности клетки.
Первоначально в результате микроскопических наблюдений остатков клеточных стенок после удаления из них либо углеводов, либо лигнина было выдвинуто предположение о чисто механической связи лигнина с углеводами (инкрустационная теория). Однако трудность разделения углеводов и лигнина привела к заключению о существовании между ними химической связи. Во всех случаях извлечения лигнина из клеточных стенок органическими растворителями (фенолом, спиртами, уксусной кислотой, диоксаном и др.) необходимы хотя бы малые количества кислотного катализатора (0,1 -- 1 % НС1 или Н2ЅО4), который, по-видимому, разрушает химическую связь между углеводами и лигнином. Извлечь целлюлозу из древесины ее растворителем-- медноаммиачным раствором можно лишь после предварительной обработки древесины 1%-ной Н2ЅО4 }. Следовательно, невозможно и извлекать углеводы из древесины без одновременного частичного удаления лигнина, ни полностью удалить лигнин из древесины без удаления некоторого количества углеводов. Доказательством существования химической связи лигнина с углеводами служит также выделение из древесины лигноуглеводных комплексов.
Часть лигнина, по-видимому, находится в свободном состоянии. Этот лигнин может извлекаться такими растворителями, как спирт, диоксан, в отсутствии катализаторов. Другая часть лигнина может быть выделена из растительных тканей толькопри помощи сравнительно жестких реакций, которые в какой-то степени изменяют природу самого лигнина.
В различных слоях клеточной стенки, по-видимому, существует различный характер лигноуглеводных связей.
Вопрос о том, с какими именно углеводами связан лигнин, окончательно еще не изучен. Как показали исследования, лигнин может проникать внутрь микрофибрилл целлюлозы и этим затруднять разделение лигнина и целлюлозы. Некоторые исследователи допускают и возможность химической связи лигнина с целлюлозой. Большинство же исследователей склоняются к предположению о существовании химической связи лигнина с гемицеллюлозами. Образование таких связей, по-видимому, происходит уже в процессе биосинтеза лигнина. Промежуточные продукты биосинтеза лигнина -- олиголигнолы могут присоединяться в некоторых местах к молекулам полисахаридов, а затем за счет соединения олиголигнолов образуются молекулы лигнина, в результате чего лигнин оказывается распространенным по всей клеточной стенке. При этом, как уже указывалось выше, в разных слоях клеточной стенки возникают связи различного характера. Считают, что в срединной пластинке лигнин связан с полиуронидами, а во вторичной стенке -- с ксиланом, маннаном и другими полисахаридами. Однако вопрос о связи лигнина с углеводами в древесине требует дальнейшего исследования.
В настоящее время предполагают возможным существование следующих основных типов связей лигнина с полисахаридами:
1. Простая эфирная связь в б-положении боковой цепочки лигнина, образующаяся за счет бензилспиртовых гидроксилов лигнина и спиртовых гидроксилов гемицеллюлоз
Эта связь легко гидролизуется кислотами, но сравнительно устойчива к щелочному гидролизу.
2. Сложноэфирная связь в б-положении боковой цепочки лигнина, образующаяся за счет бензилспиртового гидроксила лигнина и карбоксильных групп уроновых кислот (в глюкуроноксиланах, полиуронидах срединной пластинки)
Связь такого типа легко гидролизуется даже при мягком щелочном гидролизе.
3. Фенилглюкозидная связь, образующаяся за счет фенольных гидроксилов лигнина и глюкозидных гидроксилов углеводов
Глюкозидные связи такого типа гидролизуются кислотами, но труднее глюкозидных связей в макромолекулах полисахаридов.
4. Полуацетальные (гемикетальные) связи, образующиеся за счет карбонильных групп лигнина в в-положении и спиртовых гидроксилов углеводов
где R-остаток углевода.
Кроме вышеуказанных легко гидролизуемых кислородных связей при сочетании радикалов в процессе биосинтеза могут образовываться кислородные связи других типов, устойчивые к гидролизу, а также углерод-углеродные связи.
Наряду с химическими связями немаловажную роль могут играть водородные связи. Наличие в лигнине водородных связей подтверждено исследованиями ИК-спектров лигнина. Однако следует заметить, что до настоящего времени имеются лишь косвенные доказательства возможности существования связей всех этих типов. По-видимому, связи лигнина с углеводами многообразны. В процессе лигнификации образуются поперечные связи между молекулами лигнина и углеводов в случайных местах. Вследствие этого клеточная стенка представляет собой как бы графт-полимер пространственной структуры: целлюлоза--лигнин-- гемицеллюлозы -- лигнин -- полиурониды.
Лигнин в клеточных стенках можно распознавать по цветным реакциям. Чистая целлюлоза дает сине-фиолетовую окраску с раствором хлор-цинк-иода. Если же клеточные стенки содержат лигнин, наблюдается желто-бурое окрашивание. Длякачественного определения лигнина чаще всего применяют реакцию с солянокислым раствором флороглюцина, который дает с лигнином красное окрашивание. Предполагают, что эту цветную реакцию дают группы кониферилового альдегида
С солями анилина лигнин дает желтое окрашивание. Лигнин дает различные цветные реакции и с другими фенолами, нафтолами, ароматическими аминами, а также с некоторыми неорганическими реагентами. Одной из наиболее характерных реакций с неорганическими реагентами является реакция Мейле. При обработке сначала 1%-ным раствором КМп04 , затем соляной кислотой и аммиаком лиственная древесина окрашивается в красный цвет. Хвойная древесина характерного окрашивания не. дает. Таким образом, реакция Мейле позволяет отличать лиственные породы от хвойных.
12. Особенности химических реакций лигнина как полимера. Действие азотной кислоты на лигнин
Лигнин в химическом отношении является весьма реакционноспособным. Как и любой полимер, лигнин способен к реакциям элементарных звеньев (реакциям функциональных групп и внутримолекулярным перегруппировкам) и к макромолекулярным реакциям. Следует заметить, что реакции внутримолекулярных перегруппировок в химии лигнина играют сравнительно большую роль. В реакциях функциональных групп могут участвовать все известные функциональные группы лигнина (ароматическое кольцо, гидроксильные и карбонильные группы, двойные связи). Для лигнина характерны также реакции деструкции, которые могут протекать с разрывом простых эфирных связей, а в некоторых случаях и с разрывом более устойчивых углерод-углеродных связей. Особенностью химического поведения лигнина является значительная роль реакций сшивания цепей. Высокой реакционной способностью лигнина объясняются легко протекающие реакции конденсации с образованием новых углерод-углеродных связей и возрастанием молекулярной массы. У лигнина особенно ярко проявляется характерное свойство полимеров -- одновременное протекание реакций нескольких типов.
К реакциям элементарных звеньев относятся реакции замещения в ароматическом кольце (хлорирование, нитрование, мсркурирование и др.). При изучении лигнина широко применяются реакции алкилирования гидроксильных групп и особенно метилирование, например, метилирование диметилсуль-фатом в присутствии щелочи, метилирование диазометаном (см. выше), реакции алкилирования кислых групп (фенольных, энольных и карбоксильных) галоидными алкилами в присутствии щелочи с получением разнообразных простых и сложных эфиров лигнина.
Из реакций функциональных групп наибольшее значение имеют реакции гидроксильных групп бензилового спирта, о чем уже говорилось выше. В процессах делигнификации щелочным способом важную роль играют фенольные гидроксилы, образующие в этих условиях феноляты и тем самым способствующие растворению лигнина.
Для технологических процессов большое значение также имеют реакции замещения в ароматическом кольце -- хлорирование, нитрование, сопровождающиеся, как правило, окислительной деструкцией лигнина.
Реакции окислительной и гидролитической деструкции лигнина используются для перевода его в растворимое состояние и удаления из растительных тканей (процесс делигнификации), а также для изучения химического строения лигнина. Однако, как правило, реакции гидролитической деструкции идут одновременно с реакциями сшивания цепей (реакциями конденсации). Эту особенность необходимо учитывать при проведении подобных реакций.
Действие на лигнин азотной кислоты
Азотная кислота нашла применение для делигнификации древесины с целью получения целлюлозы. Разработан так называемый азотно-щелочной способ варки целлюлозы, заключающийся в обработке древесины разбавленной азотной кислотой НМОд (2--7%-ной) при температуре близкой к температуре кипения. Лигнин нитруется и окисляется азотной кислотой, а гемицеллюлозы гидролизуются. Продукты распада лигнина удаляются при обработке разбавленным раствором ЫаОН при нагревании. Особенно хорошие результаты этот способ дает при варке лиственной древесины и однолетних растений.
На делигнификации азотной кислотой основан также способ количественного определения содержания целлюлозы в древесине (способ Кюршнера).
...Подобные документы
Методы выделения холоцеллюлоза. Содержание и состав гемицеллюлоз хвойной и лиственной древесины. Гидролитическая деструкция, ацидолиз и этанолиз лигнина - ароматического полимера. Химия его сульфитной и сульфатной варки. Нитраты целлюлозы, их получение.
учебное пособие , добавлен 03.01.2014
Методы получение сульфатов целлюлозы древесины. Получение сульфатов микрокристаллической целлюлозы, область их практического применения. Специфика и методика проведения эксперимента. Перечень оборудования и реактивов. Изучение полученных данных.
научная работа , добавлен 20.01.2010
Химические компоненты древесины. Способы получения целлюлозы: сульфатный и сульфитный. Расчет выхода целлюлозного продукта. Методика определения лигнина с 72%-ной серной кислотой в модификации Комарова. Нахождение средней степени полимеризации целлюлозы.
дипломная работа , добавлен 13.06.2015
Задачи химической кинетики, стадии химического процесса. Открытые и замкнутые системы, закон сохранения массы и энергии. Закон Гесса и его следствие, скорость реакций. Явление катализа, гомогенные, гетерогенные, окислительно-восстановительные реакции.
курсовая работа , добавлен 10.10.2010
Химические превращения компонентов древесины в условиях сульфатной варки. Показатели качества технических целлюлоз. Определение равномерности отбелки целлюлозы и способа варки. Химические и физико-химические анализы. Идентификация целлюлозных волокон.
курсовая работа , добавлен 16.05.2011
Гетерогенные и гомогенные системы. Равновесие, устанавливающееся на границе раздела фаз. Межмолекулярные взаимодействия между растворителем и веществом с образованием сольватов. Концентрация насыщенного раствора. Природы вещества и растворителя.
презентация , добавлен 25.03.2014
Гомогенные и гетерогенные реакции: мрамора с соляной кислотой. Факторы, влияющие на скорость химических реакций. Закон действующих масс. Правило Вант-Гоффа. Катализатор нейтрализации выхлопных газов автомобиля. Три признака химического равновесия.
презентация , добавлен 27.04.2013
Классификация, строение полимеров, их применение в различных отраслях промышленности и в быту. Реакция образования полимера из мономера - полимеризация. Формула получения полипропилена. Реакция поликонденсации. Получение крахмала или целлюлозы.
разработка урока , добавлен 22.03.2012
Классификация углеводородов, их функциональные производные. Реакции полимеризации, особые механические и химические свойства полимеров. Общие принципы производства искусственных волокон. Ацетатное волокно, химическое строение, получение, свойства.
контрольная работа , добавлен 29.03.2013
Химические соединения с высокой молекулярной массой (от нескольких тысяч до многих миллионов). Свойства и важнейшие характеристики, получение, применение. Поверхностно-активные вещества: молекулярное строение и получение, свойства и применение.
Cтраница 1
Спиртовые растворы камфоры вызывают только набухание трипропио-ната целлюлозы несмотря на то, что он растворяется в расплаве камфоры.
Для испытания на кислоту спиртовой раствор камфоры выливают в воду и титруют.
Качественное открытие камфоры: 4 мл спиртового раствора камфоры (не свыше 0 04 г) смешивают с 2 каплями 1 % - ного спиртового раствора фурфурола, к смеси медленно приливают (без перемешивания) 2 мл концентрированной серной кислоты. Смесь окрашивается в чистый синий цвет. Борнеол дает окраску фиолетового тона, ментол также фиолетовую, изменяющуюся в синюю.
При изготовлении целтулоида нитроцеллюлозу (коллоксипнн) в мешатслях обрабатывают спиртовым раствором камфоры.
Для получения целлулоида нитроцеллюлоза (коллоксилин) обрабатывается в мешателях спиртовым раствором камфоры.
Получается путем смешения нитроцеллюлозы (нитроклетчатки или коллоксилина) со спиртовым раствором камфоры, играющей роль пластификатора.
Для получения целлулоида нитроцеллюлозу смешивают при 85 - 90 в вакуум-мешателе со спиртовым раствором камфоры. Из полученной гомогенной массы удаляют растворитель, массу фильтруют в фильтр-прессе под давлением до 300 am при 70 - 88 и для придания ей полной однородности вальцуют на горячих вальцах. При вальцевании в массу вводят краситель и другие компоненты.
При изготовлении целлулоида нитроцеллюлозу (коллоксилин) в аппаратах с мешалками обрабатывают спиртовым раствором камфоры. Полученная масса пластифицируется обработкой на вальцах и в специальных блок-прессах.
Процесс изготовления целлулоида сводится к подготовке исходного сырья (кроме других операций, сюда относятся обезвоживание нитроцеллюлозы спиртом, в подготовке спиртокам-фарного раствора); смешиванию нитроцеллюлозы со спиртовым раствором камфоры; фильтрованию, вальцеванию и прессованию массы в блок; строганию блока, сушке, выпрямлению, полировке и обрезке полученных листов.
Сообщение об оптической активности органических жидкостей (терпентинного и других растительных масел, а также спиртового раствора камфоры) он сделал в 1815 г., растворов тростникового сахара - в 1818 г., а об инверсии вращения плоскости поляризации тростниковым сахаром после гидролиза - в 1832 г. В этом году он докладывал в Парижской академии (опубликовано в 1835 г.) О круговой поляризации и ее применении в органической химии, впервые упоминая об оптической активности винной кислоты.
Этот метод известен еще со времен Паркса, который получил целлулоид, замешивая нитрат целлюлозы со спиртовым раствором камфоры. В производстве пластифицированного ацетата целлюлозы (целлона) применяют раствор диметилфталата с арилсульфамидами или с трифенилфосфатом в спирто-бензольной смеси.
Отмечено, что спиртовые растворы камфоры можно использовать для получения геля нитрата целлюлозы. Это обстоятельство использовано фирмой Hyatt в производстве целлулоида. При добавлении к растворимому в эфире нитрату целлюлозы 10 % - ного спиртового раствора камфоры происходит только сильное набухание даже при введении до 100 % камфоры. Повышение концентрации камфоры в спиртовом растворе до 20 % приводит к растворению нитрата целлюлозы лишь в том случае, если одновременно отношение нитрата целлюлозы к камфоре достигает. Однако такая дозировка камфоры слишком велика для переработки нитрата целлюлозы. При получении целлулоида из растворимого в спирте нитрата целлюлозы тоже применяется примерно 20 % - ный раствор камфоры. В растворе камфоры такой концентрации весь нитрат целлюлозы превращается в гель.
Краус Б6, пользуясь разработанным им методом определения продолжительности растворения пленки нитрата целлюлозы в пластификаторах или их растворах, установил, что при прочих равных условиях пленка с ацетанилидом растворяется быстрее, чем пленка с камфорой. Сравнивая этилацетанилид с другими твердыми пластификаторами, Краус нашел, что только пленки, пластифицированные этилацетанилид ом, растворяются в толуоле, и то в течение двух суток. Пленка нитрата целлюлозы Е растворяется в 50 % - ном спиртовом растворе этилацетанилида в течение 255 мин, а в 50 % - ном спиртовом растворе камфоры в течение 348 мин. Даже в 25 % - ном растворе этилацетанилида в смеси толуола со спиртом (2: 1) пленка растворяется быстрее.
Страницы: 1
Cтраница 3
Согласно данным91, полученным при исследовании растворов нитрата целлюлозы в ацетоне и нитробензоле, среднеквадратичное расстояние между концами цепи в ацетоне более чем в 2 раза превосходило аналогичную характеристику конформации макромолекулы для раствора в нитробензоле, что свидетельствует о значительно большей степени асимметрии макромолекулы в ацетоне.
Первый патент на получение искусственного волокна из раствора нитрата целлюлозы в смеси спирта и эфира, смешанного с раствором каучука в эфире, получен Аудермасом в Англии в 1853 г. Девять лет спустя в Парижскую академию наук поступила статья Озанама, в которой на основании изучения процесса ните-образования у шелковичных червей предлагалось для формования искусственного волокна применять фильеры.
Грунтовка НЦ-0140 представляет собой суспензию пигментов в растворе нитрата целлюлозы, алкидной смолы с добавкой пластификатора.
Аналогичные данные были получены Бога-пом и др. для раствора нитрата целлюлозы в различных кетонах.
Мембраны из денитрированного коллодия приготовляют осторожным испарением растворителя из растворов нитрата целлюлозы в смеси спирта и эфира и последующим денитри-рованием образовавшейся пленки при помощи водно-спиртового раствора сульфида аммония , Боун с сотрудниками установили, что проницаемость мембран из гидро-лизованного нитрата целлюлозы может быть изменена добавкой целлозольва (моноэтиловый эфир этиленгликоля) к растворам нитрата целлюлозы; чем в большей пропорции введен целлозольв, тем менее проницаема мембрана; Клевер дон и Лэйкер изменяли проницаемость, варьируя соотношение количеств этанола и эфира в растворе, из которого получали пленку. Клевердоном даны очень подробные инструкции по приготовлению мембран этого типа. Данные Клевер дона и Лэйкера , Альванга и Сэмуельсона и Филиппа и Бьерка хорошо иллюстрируют возможные изменения констант проницаемости и избирательности.
Многие современные лаки на основе нитратов целлюлозы производят из высоковязких эфирноспиртовых растворов нитратов целлюлозы, так называемого коллодия, который (в виде цапонлака) вплоть до Первой мировой войны играл значительную, но все же ограниченную роль для покрытия дерева, бумаги или металла.
Замазка НГ (ТУ МХП 3425 - 52) - раствор нитрата целлюлозы и глифталевой смолы ФЛ-39 в смеси растворителей и разбавителей с добавками талька и алюминиевой пудры и пластификатора. Серебристовяз-кая масса без посторонних включений, легко наносимая шпателем на поверхность. Разбавляется разжижителем РДВ, этилацетатом и бутилацетатом.
Смывка АФТ-1 (ТУ МХП 2648 - 51) - раствор нитрата целлюлозы, этил - или бензол-целлюлозы и парафина в смеси ацетона, фор-мальгликоля и толуола или ксилола. Предназначается для снятия масляных или на основе нитрата целлюлозы лакокрасочных покрытий - набухание или размягчение не позднее 20 мин после нанесения смывки.
1.3 Свойства нитратов целлюлозы
^ 1.3.1 Структура и физические свойства
Нитраты целлюлозы имеют внешнее сходство с исходной целлюлозой (в обычном неполяризованном свете). Это твердые волокнистые вещества белого или желтоватого цвета, не имеющие запаха. Гетерогенный характер реакции этерификации способствует сохранению и морфологической структуры (надмолекулярных образований) этерифицируемой целлюлозы. Простейшим надмолекулярным образованием является пачка (элементарная фибрилла), состоящая из макромолекулярных цепей. Пачки могут агрегироваться, создавая более крупные структурные образования – микрофибриллы, фибриллы, являющиеся основой стенок волокон.
Нитраты целлюлозы характеризуются неоднородной структурой. Даже в пачке макромолекулы упакованы неодинаково, имеют участки с высокой и низкой степенью ориентации, различающиеся по реакционной способности к гидролизу, этерификации и т.д. При этом участки с высокой степенью ориентации подобны кристаллической структуре, что позволяет считать нитраты целлюлозы как и исходную целлюлозу, полимерами аморфно-кристаллического строения. Рентгенографические исследования показали, что для нитратов целлюлозы содержание упорядоченных участков составляет 20-30 % и возрастает с увеличением степени этерификации .
Плотность нитратов целлюлозы зависит от содержания азота (таблица 1).
Таблица 1 – Зависимость плотности нитратов целлюлозы от содержания азота
Гигроскопичность нитратов целлюлозы ниже, чем у целлюлозы. Она тем ниже, чем выше степень замещения. Суммарное содержание влаги и азота в нитратах целлюлозы при относительной влажности воздуха до 80 % является постоянной величиной
Где N – массовая доля азота, %; H 2 O – массовая доля воды, %.
Нитраты целлюлозы хорошо сорбируют пары органических растворителей, а из водных растворов – соли, кислоты, красители, хуже - гидроксиды металлов.
^ 1.3.2 Химические свойства
Химические свойства нитратов целлюлозы связаны с особенностями химического строения их макромолекул. В макромолекулах содержатся три типа реакционных центров, способных к различным превращениям: сложноэфирные нитратные группы, свободные незамещенные гидроксильные группы, гликозидные связи. В реакции участвуют одновременно все три типа центров, причем реакционная способность каждого из них находится в прямой зависимости от соседнего окружения в элементарном звене и изменяется в процессе реакции.
Реакции по гликозидным связям всегда приводят к деструкции полимерной цепи. Гидроксильные группы играют важную роль в межмолекулярных связях. Большинство химических взаимодействий нитратных групп можно условно разделить на реакции гидролиза, в результате которых могут восстанавливаться гидроксильные группы либо образовываться ангидро или оксидные формы, а также на реакции нуклеофильного и электрофильного замещения поляризованных эфирных связей.
Нитраты целлюлозы в отличие от целлюлозы относительно устойчивы к действию кислот, их действие зависит от концентрации. Так, серная кислота с массовой долей до 20 % на нитраты целлюлозы почти не действует, а ее растворы массовой долей 0,2 – 0,3 % не вызывают изменений в нитратах целлюлозы даже при длительном кипячении, что используется в процессе их стабилизации. Эта кислота массовой долей более 20 % вызывает денитрацию нитратов целлюлозы, 98 % не только денитрует, но и деструктирует их, а при повышении температуры идет разложение до образования оксидов азота и диоксида углерода. Серная кислота с массовой долей 92 % при минусовых температурах денитрует и растворяет нитраты целлюлозы (это свойство используется при определении содержания азота по методу Лунге).
Растворы азотной кислоты с массовой долей 50 % и выше при минусовых температурах медленно денитруют и деструктируют нитраты целлюлозы, при нагревании до 70 –80 єС происходит их быстрый распад. Фосфорная кислота с концентрацией 100 % при температурах 15 – 25 єС не взаимодействует с нитратами целлюлозы. Органические кислоты, например, уксусная, даже в концентрированных растворах (50-60 %) практически не влияют на нитраты целлюлозы, но при концентрации 80 % и кипячении вызывают быстрое разрушение нитратов целлюлозы с выделением оксидов азота.
Малая чувствительность нитратов целлюлозы к действию разбавленных кислот не означает, что такая примесь не отразится на их качестве. Длительный контакт с разбавленными кислотами ведет к потере химической стойкости нитратов целлюлозы.
Нитраты целлюлозы малочувствительны к окислителям. Даже такие сильные окислители, как перманганат калия или хлорноватистая кислота, не вызывают заметного изменения их свойств. Это свойство используется при отбелке высококачественных коллоксилинов. В тоже время оксиды азота денитруют и окисляют нитраты целлюлозы. Газообразный NO 2 приводит к образованию карбоксильных групп у шестого углеродного атома и денитрации нитратных групп у второго и третьего углеродных атомов с регенерацией гидроксильной группы. Скорость и полнота этих процессов увеличиваются с повышением содержания воды в нитратах целлюлозы.
Действуя на нитраты целлюлозы восстановителями, например, гидросульфидом натрия, можно регенерировать целлюлозу без изменения ее химических свойств. Восстановителями нитратов целлюлозы являются хлористое и двууксусное железо, железный купорос, хлористое олово. Реакции восстановления могут сопровождаться побочными процессами, уменьшающими степень полимеризации.
В отличие от целлюлозы нитраты целлюлозы очень чувствительны к действию щелочных растворов, концентрация щелочи в которых превышает 0,1 %. При контакте нитратов целлюлозы со щелочью происходит отщепление нитратных групп. Появляющиеся в результате этой реакции гидроксильные группы окисляются с образованием функциональных альдегидных, кетонных и карбоксильных групп. Это приводит к деполимеризации, а затем к распаду гликозидных остатков в результате разрыва связей между углеродными атомами С 1 –С 5 и С 2 –С 3 . Растворы щелочей действуют тем энергичнее, чем выше концентрация щелочи и температура. Содовые растворы оказывают меньшее разрушающее действие и широко применяются в производстве для стабилизации нитратов целлюлозы, так как легко разрушают нестабильные примеси.
^ 1.3.3 Взаимодействие с окружающей средой
Нитраты целлюлозы чувствительны к свету, нагреву, влаге. При интенсивном и длительном действии света на нитраты целлюлозы наблюдается медленное разложение нитратов целлюлозы. При этом уменьшается содержание азота, появляются газообразные продукты разложения (диоксиды углерода, азот и оксиды азота), уменьшается масса нитратов целлюлозы, их механическая прочность, вязкость, способность растворяться в органических растворителях, параллельно происходит пожелтение. Чем выше вязкость нитратов целлюлозы, тем больше времени требуется до начала разложения под действием света.
Разложение нитратов целлюлозы происходит при нагревании. Длительный нагрев при температуре более 60 єС приводит к деструкции и термическому распаду нитратов целлюлозы. В продуктах разложения содержатся оксиды азота, углерода, вода, органические соединения (формальдегид, муравьиная кислота, метан и т.д.). Установлено, что при разных температурах образуются различные продукты разложения . Так, при температурах ниже 125 єС образуется большое количество воды, выделяются оксиды углерода, оксид азота, свободного азота выделяется мало, зато в оставшемся продукте содержится много азота. При температурах 130 – 145 єС резко уменьшается содержание азота в продукте, оставшемся после разложения. При 150 – 160 єС происходит разложение со взрывом. Скорость разложения нитратов целлюлозы под действием температуры увеличивается с увеличением в них содержания азота, температура вспышки соответственно понижается.
Нитраты целлюлозы гидролизуются во влажной атмосфере. Гидролиз сопровождается реакциями окисления и восстановления, в результате которых образуется большое количество низкомолекулярных соединений. Образующиеся продукты окисления могут быть катализаторами гидролитического разложения. Среди продуктов гидролитического разложения обнаруживаются органические кислоты, азотистая кислота, окислы азота, этилнитрат, этиловый спирт, углеводы и др. Наименьшая скорость гидролиза наблюдается при рН=7.
^ 1.3.4 Взрывчатые свойства
Причиной взрывчатых свойств у нитратов целлюлозы является наличие нитратных групп. Нитраты целлюлозы чувствительны к различным воздействиям (удару, трению, искре). В большей степени эти свойства проявляются у высокоазотных нитратов целлюлозы – пироксилинов.
Очень чувствителен к удару стальным предметом сухой пироксилин. Эти свойства подсохшего пироксилина необходимо учитывать в производственных условиях.
С увеличением влажности чувствительность пироксилина снижается. При содержании 20 % влаги пироксилин не детонирует при ударе. При влажности примерно 30 % пироксилин считается безопасным в обращении. Даже капсюль – детонатор не вызывает в нем детонацию. Но при наличии в нем небольшого количества сухого пироксилина (играющего роль промежуточного детонатора) такой пироксилин может сдетонировать.
Все виды нитратов целлюлозы с влажностью более 12 % при температуре 20 – 40 єС нечувствительны к трению (в условиях стандартных испытаний), а также не загораются от огнепроводного шнура.
Чувствителен сухой пироксилин к ударной волне. Горение пироксилина при определенной плотности и давлении может переходить в детонацию. Чем меньше плотность и выше давление, тем больше возможности перехода горения в детонацию. Скорость детонации прессованного пироксилина равна 6500 – 7500 м/с при плотности 0,8 – 1,3 г/см 3 соответственно.
Чувствительность пироксилина к электрической искре зависит от его дисперсности, влажности, температуры и влажности окружающего воздуха. Минимальная энергия воспламенения нитратов целлюлозы при их дисперсности 0,2 – 0,3 мм и влажности не более 4 %, температуре окружающего воздуха 18 – 22 єС и относительной влажности 40 – 70 % составляет 2·10 -2 Дж . Вероятность воспламенения от искрового заряда увеличивается, если нитраты целлюлозы находятся во взвешенном состоянии.
Результаты испытаний нитратов целлюлозы на отдельные виды воздействий приведены в таблице 2.
Таблица 2 – Взрывчатые свойства нитратов целлюлозы
Продолжение табл. 2
Подробные данные по чувствительности к удару, бризантности, фугасному действию и чувствительности к электрической искре приведены в работе .
1.3.5 Растворимость
Растворимость нитратов целлюлозы зависит от природы растворителя, условий растворения, а также от свойств нитратов целлюлозы (содержания азота, вязкости, однородности по степени этерификации и молекулярно-массовому распределению). Нитраты целлюлозы любой степени замещения нерастворимы в воде, но растворимы во многих органических растворителях. Все растворители нитратов целлюлозы имеют в своих молекулах полярную группу.
Универсальный растворитель нитратов целлюлозы различной степени этерификации – ацетон. Нитраты целлюлозы с массовой долей азота 9 – 11 % растворяются в этиловом спирте, с массовой долей 11 – 12,8 % хорошо растворяются в кетонах, сложных эфирах уксусной кислоты, метиловом спирте, диоксане, этиленгликоле и др.
Большое практическое значение имеют комбинированные растворители, состоящие из одного или двух активных растворителей, одного или нескольких скрытых растворителей и разбавителей со слабым растворяющим действием, широко применяемые в лакокрасочной промышленности.
Бинарные смеси растворителей позволяют получить оптимальный эффект растворения нитратов целлюлозы. Наиболее известна спиртоэфирная смесь. Растворитель такого состава применяется при изготовлении порохов. Растворимость нитратов целлюлозы в спиртоэфирном растворителе зависит от соотношения в нем компонентов и содержания азота в нитратах целлюлозы. На рис.1 приведена зависимость растворимости нитратов целлюлозы от содержания в них азота при соотношении спирта и эфира 1:2 .
Из рисунка следует, что зависимость имеет сложный характер. Нитраты целлюлозы с содержанием азота до 7 % почти не растворяются. С увеличением содержания азота их растворимость увеличивается и остается высокой
Рисунок 1 - Зависимость растворимости нитратов целлюлозы в спиртоэфирном растворителе от содержания в них азота
до 12,6 % азота, а затем быстро падает. Наибольшую растворимость имеют нитраты целлюлозы с содержанием азота 10,5 – 12,6 %. Верхнее значение азота примерно соответствует пироколлодию Менделеева, сочетающему высокое содержание азота с почти полной растворимостью в спиртоэфирном растворителе.
Влияние температуры на растворимость нитратов целлюлозы незначительно. При этом большое значение имеет природа растворителя. Так, например, растворимость нитратов целлюлозы в спиртоэфирной смеси повышается с понижением температуры, а в нитратах многоатомных спиртов, например, нитроглицерине, наоборот, уменьшается.
Кроме жидких растворителей, имеются вещества, с которыми нитраты целлюлозы полностью совмещаются, образуя вязкую массу, например, камфара. Смесь камфары со спиртом применяется при изготовлении целлулоида.
Такие вещества, как касторовое масло, вазелин, вазелиновое масло, не совмещаются с нитратами целлюлозы, но небольшие их количества (не более 1 – 3 % от массы полимера), играя роль «смазки» между надмолекулярными образованиями, влияют на деформационные свойства и облегчают их переработку.
1.3.6 Вязкость
Под вязкостью нитратов целлюлозы понимается вязкость их стандартных растворов. При одинаковом содержании азота в нитратах целлюлозы и близких молекулярно-массовых распределениях вязкость дает информацию о средней степени полимеризации, которая в значительной мере предопределяет физико-химические свойства изделий на основе нитратов целлюлозы. При одних и тех же условиях испытания (природа растворителя, концентрация раствора, температура) и при одной и той же степени этерификации вязкость тем больше, чем выше степень полимеризации нитратов целлюлозы.
В производстве лаков и красок для обеспечения технологичности раствора требуются нитраты целлюлозы малой вязкости, что соответствует степени полимеризации в пределах 100 – 300. Допускать чрезмерного снижения вязкости нельзя, так как низкая вязкость снижает прочность пленки, образующейся при покраске. В целлулоидном коллоксилине допускается степень полимеризации 350 – 600.
Большое значение имеет вязкость пироксилинов в производстве пироксилиновых порохов. Уменьшение вязкости облегчает формирование порохового шнура, ускоряет и улучшает пластификацию пороховой массы, снижает расход растворителя (дозировочный коэффициент растворителя). Однако очень низкая вязкость пироксилина уменьшает механическую прочность пороха.
В пороховой промышленности используется условная вязкость, выраженная в градусах Энглера (1є Э равен 6 сП) и определяется на стандартных ацетоновых растворах с помощью вискозиметра Энглера. Наиболее рациональной условной вязкостью для пироксилина №1 считается 6 – 10 єЭ (36 – 60 сП), для пироксилина №2 – 4 –8 єЭ (24 – 48 сП). В заводских условиях пироксилин №1 получают вязкостью 8 – 12 єЭ (48 – 72 сП), пироксилин №2 вязкостью 6 – 10 єЭ (36 – 60 сП), что соответствует степени полимеризации 1000 – 1200 .
В лакокрасочной промышленности применяются коллоксилины, их качество оценивается по вязкости растворов в комбинированном растворителе. За условную вязкость этих растворов принимается время (в секундах) прохождения стального шарика диаметром 7,938 мм слоя высотой 250 мм в вертикально установленной трубке, наполненной испытуемым раствором. Корреляция между вязкостями, определенными по приведенным методикам, не существует, так как растворители имеют разную активность по отношению к испытываемым нитратам целлюлозы, кроме того, испытываемые растворы по этим методикам имеют различную концентрацию.
Концентрированные растворы нитратов целлюлозы, так же, как и любые концентрированные растворы полимеров, характеризуются аномалией вязкости. Она не является постоянной величиной, а зависит от напряжения сдвига. С увеличением концентрации вязкость растворов растет как и у других полимеров не пропорционально концентрации, так как появляется структурная вязкость, обусловленная взаимодействием молекул в растворе.
Вязкость растворов в смешанных растворителях зависит не только от вязкости самого нитрата целлюлозы, но и от соотношения компонентов растворителя, причем кривая зависимости вязкости от состава смеси растворителей обычно проходит через минимум, который отвечает лучшей растворяющей способности смеси. Пример такой зависимости для 4 % раствора нитрата целлюлозы с содержанием 12,2 % азота в спиртоэфирном растворителе дан на рис. 2 .
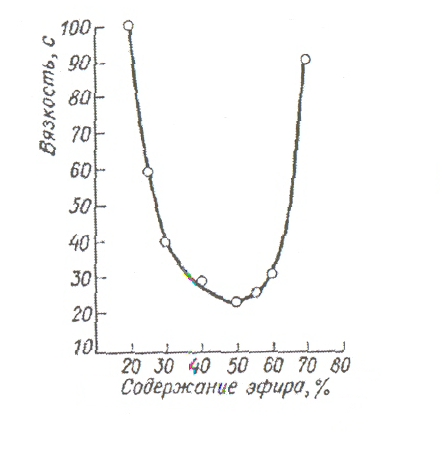
Рисунок 2 - Зависимость вязкости спиртоэфирных растворов нитратов целлюлозы от состава растворителя
из исходных нитратов целлюлозы. Причем, чем больше разница условных вязкостей исходных нитратов целлюлозы, тем хуже физико-механические характеристики .
^ 1.3.7 Химическая стойкость
По своей природе нитраты целлюлозы относительно нестойкие соединения. Для них характерно самопроизвольное химическое разложение даже при умеренных температурах. С повышением температуры скорость разложения увеличивается. Поэтому в пороховой промышленности под химической стойкостью нитроцеллюлозы понимается их способность сопротивляться разложению.
Разложение нитратов целлюлозы заключается в их распаде с выделением различных продуктов (оксидов азота, оксидов углерода, воды и др.). Продукты разложения химически активны, они реагируют между собой и с нитратами целлюлозы. Газообразные продукты распада NO 2 , NO, пары воды и азотной кислоты являются катализаторами процесса разложения. В результате их действия процесс разложения ускоряется. Наиболее активную роль в этом процессе играет диоксид азота NO 2 . Он действует как за счет непосредственного окисления нитрата целлюлозы, восстанавливаясь при этом до NO, а последний, окисляясь, дает снова NO 2 , так и за счет образования неорганических кислот, способствующих протеканию гидролиза.
Суммарный процесс распада нитратов целлюлозы является экзотермическим. Прогрессивное повышение температуры при высоких скоростях распада может привести к самовоспламенению и горению нитратов целлюлозы.
Воздействие внешних условий (тепла, влаги и т.д.) способствует снижению химической стойкости нитратов целлюлозы. Особенно сильно на химическую стойкость влияет содержание в них серной кислоты как связанной, так и свободной. Связанная серная кислота находится в виде смешанных серно-азотных эфиров. Свободную серную кислоту, находящуюся внутри волокон, называют «закапсюлированной» кислотой.
Снижают химическую стойкость нитратов целлюлозы также присутствующие и образующиеся при нитрации нестойкие примеси и побочные вещества, например, нитропродукты гидролиза и окисления целлюлозы (нитросахара). Поэтому при изготовлении нитратов целлюлозы требуется технологическая операция – стабилизация. Она заключается в удалении из нитратов целлюлозы кислот и побочных продуктов.
Химическая стойкость определяется количеством оксидов азота, выделяемых из 1 г нитратов целлюлозы при нагревании в течение 2 часов при 132±0,4 єС. Метод основан на том, что процесс разложения нитратов целлюлозы идет при высокой температуре в том же направлении, что и при низкой, различаясь только по скорости (закон Бертло). Однако это наблюдается тогда, когда условия разложения испытываемого продукта при низких температурах практически не отличаются от условий их разложения при высоких температурах.
В пороховой промышленности приняты следующие требования к химической стойкости: для пироксилина №1 – 3 мл NO/г, для пироксилина №2 – 2 мл NO/г. Для пироксилина №2 значение химической стойкости достигается относительно легко, а для пироксилина №1 стабилизация является сложной операцией, требующей значительного времени.
2 Сведения о сырье и материалах, используемых в производстве нитратов целлюлозы
Основным сырьем для получения нитратов целлюлозы является целлюлоза. В производстве применяются также азотная кислота, серная кислота или олеум, используемые для приготовления нитрующих смесей; сода (карбонат натрия) – для стабилизации полученных нитратов целлюлозы; техническая вода, применяемая как транспортное средство при передаче нитратов целлюлозы между фазами, для приготовления соответствующих растворов, отмывки нитратов целлюлозы от примесей и т.д.
Введение
Простые эфиры целлюлозы С 6 Н 7 О 2 (ОR) n (ОН) 3-n (где n≈2) представляют собой в основном продукты О-алкилирования целлюлозы. Простые эфиры целлюлозы в настоящее время приобрели большое практическое значение. К достоинствам простых эфиров целлюлозы относятся: устойчивость к действию химических реактивов, водостойкость, морозостойкость, светостойкость, термостойкость, малая горючесть, способность растворяться в распространненых органических растворителях, хорошие пленкообразующие и термопластические свойсва и другие. Некоторые простые эфиры целлюлозы при определенной степени замещения могут растворяться не только в органических растворителях, но и в разбавленных водных растворах щелочи и даже в холодной воде. Это также играет важную роль в их применении. При степени замещения 2 – 2,5 простые эфиры растворимы в органических растворителях, при степени замещения менее единицы эфиры растворимы в щелочах. При одинаковой степени замещения растворимость тем ниже, чем выше молекулярная масса замещенного радикала.
Различают следующие виды простых эфиров целлюлозы: алкилцеллюлозы (метил-, этилцеллюлозы и другие); аралкилцеллюлозы (бензилцеллюлоза); гидроксиалкилцеллюлоза (гидроксиэтил-, гидроксипропилцеллюлоза); эфиры, содержащие в алкильном заместителе другие группы, помимо гидроксильных, например, карбоксильные и другие (карбоксиметилцеллюлоза, цианэтилцеллюлоза и так далее); смешанные простые эфиры целлюлозы (карбоксиметилэтилцеллюлозы и другие). В последнее время получено большое число простых эфиров целлюлозы, содержащих различны функциональные группы. Кроме того, известны эфиры целлюлозы, содержащие одновременно простые эфирные и сложноэфирные группы.
1. Представители проcтых эфиров целлюлозы
1.1 Алкилцеллюлоза
Из алкилцеллюлоз в промышленности производят метил- и этилцеллюлозы. Метилцеллюлоза может быть получена с разной степенью замещения (С3) вплоть до С3 3,0. Теоретически монометилцеллюлоза содержит 17,61%, диметилцеллюлоза 32,6% и триметилцеллюлоза 45,65% групп-ОСН 3 . В промышленности получают водорастворимую метилцеллюлозу методом метилирования щелочной целлюлозы метилхлоридом :
[С 6 Н 7 О 2 (ОН) 3 ] n +хnNаОН+хnСН 3 →[С 6 Н 7 О 2 (ОН) 3-х (ОСН 3) х ] n +хnNаСl+
Получают продукты волокнистого или гранулированного строения, содержащие 24…34% групп ОСН 3 , что соответствует С3 1,3…2,6. Такая метилцеллюлоза растворима в холодной воде и ряде органических растворителей, но не растворяется в горячей воде. В водных растворах метилцеллюлоза проявляет свойства ПАВ.
Этилцеллюлозу в промышленности получают взаимодействием щелочной целлюлозы этилхлоридом :
[С 6 Н 7 О 2 (ОН) 3 ] n +хnNаОН+хnС 2 Н 5 Сl→[С 6 Н 7 О 2 (ОН) 3-х (ОС 2 Н 5) х ] n +
ХnNaСl+хnН 2 О
Триэтилцеллюлоза содержит 54,87% групп – ОС 2 Н 5 . В производстве вырабатывают этилцеллюлозу, содержащую 44…50% групп - ОС 2 Н 5 (С3 2,5…2,6) и с низкой степенью замещения (С3 1,0…1,5; 25…30% групп ОС 2 Н 5). Степень замещения в процессе этилирования регулируют изменением расхода этилхлорида, а продолжительность процесса – изменением температуры.
Техническая этилцеллюлоза представляет собой белый или слегка желтоватый порошок либо пористые чешуйки. Низкозамещенная этилцеллюлоза растворима в холодной воде. Высокозамещенная этилцеллюлоза не растворима в воде, растворима в ряде органических растворителей, устойчива к действию щелочей и разбавленных кислот. Это термопластичный полимер, хорошо совмещающийся с различными смолами и пластификаторами. Изделия из этилцеллюлозы обладают высокими механической прочностью, термо- и морозостойкостью.
1.2 Бензилцеллюлоза
Бензилцеллюлоза представляет собой простой эфир целлюлозы и бензилового спирта, получаемый взаимодейтвием щелочной целлюлозы с хлористым бензилом.
Технологический процесс получения бензилцеллюлозы может осуществляться одноступенчатым или двух ступенчатым способами.
При одноступенчатом способе процесс состоит из стадий мерсеризации целлюлозы, бензилирования, промывки, сушки.
Хлопковая целлюлоза мерсеризуется 40 - 50%-ным раствором едкого натра и после отжима от него (до трехкратной массы по отношению к исходной массе целлюлозы) подвергается созреванию в течение 24 часов.
Бензилирование проводят в стальном вертикальном аппарате, никелированном внутри. Сначала загружают щелочную целлюлозу, затем вводят бензилхлорид (из расчета 6 - 7 моль на 1 моль целлюлозы). Продолжительность процесса при 130 0 С составляет 2 – 2,5 часа.
Одновременно с основной реакцией бензилирования протекают побочные реакции с образованием бензильного спирта С 6 Н 5 СН 2 ОН и дибензилового эфира С 6 Н 5 СН 2 ОСН 2 С 6 Н 5 , которые пластифицируют бензилцеллюлозу. Полученную тестообразную бензилцеллюлозу промывают.
Для облегчения выделения бензилцеллюлозы из реакционной смеси бензилцеллюлозную тестообразную массу диспергируют с помощью эмульгаторов (олеиновой кислоты или олеинового мыла). Бензилцеллюлозу отмывают спиртом от пластификаторов, а затем горячей и холодной водой от едкого натра и хлористого натрия. Можно отмывать бензилцеллюлозу от примесей дешевым растворителем – бензином, но он более взрыво- и пожароопасен, чем спирт, и его гидрофобность затрудняет последующую отмывку водой.
Промывку спиртом проводят в шаровой мельнице или на бегунах с добавлением для диспергирования массы хлористого натрия. Недостатком такого механического диспергирования является значительная потеря спирта. После отмывки водой бензилцеллюлоза отжимается на нутч-фильтре и сушиться в вакуум-сушилке при 50 - 55 0 С.
Бензилцеллюлоза представляет собой зернистый порошок желтоватого цвета. Физико механические свойства бензилцеллюлозы зависят от степени замещения и вязкости. Она характеризуется высокой адгезией к различным поверхностям, высокой водостойкостью и хорошим диэлектрическими свойствами; растворима в большом числе растворителей. Бензилцеллюлоза – нетеплостойкий и неморозоустойчивый материал с невысокими механическими показателями: теплостойкость по Мартенсу равна 52 – 60 0 С, ударная вязкость всего 1,76 кДж/м 2 . Бензилцеллюлоза имеет высокую химическую стойкость и пластичность.
Бензилцеллюлоза применяется в основном для изготовления кабелей. Благодаря хорошей адгезионной способности бензилцеллюлоза используетя для изготовления защитных покрытий и лаков. Растворы бензилцеллюлозы применяются для получения ""вечных"" обоев декоративной моющейся бумаги, из нее получают также прессовочные и литьевые композиции для производства водо- и щелочестойких изделий.
1.3 Метилцеллюлоза
Метилцеллюлоза представляет собой простой эфир целлюлозы и метилового спирта. По внешнему виду это порошкообразный или волокнистый продукт белого цвета.
Метилцеллюлозу получают двумя путями: действием на щелочную целлюлозу диметилсульфата :
[С 6 Н 7 О 2 (ОН) 3 ] n +2n(СН 3) 2 SО 4 +2nNaОН→[ С 6 Н 7 О 2 (ОН)(ОСН 3) 2 ] n +
NNаSО 4 +3nН 2 О
Или действием хлористого метила:
[С 6 Н 7 О 2 (ОН) 3 ] n +nСН 3 Сl+nNаОН→[С 6 Н 7 О 2 (ОН) 2 (ОСН 3)] n +
NNaСl+ nН 2 О
Чаще применяют хлористый метил, так как он нетоксичен и имеет более низкую стоимость. В промышленности выпускают два вида метилцеллюлозы:
Водорастворимую – со степенью замещения 1,27 – 1,54 (22 – 26% метоксильных групп);
Щелочерастворимую – с 3 – 4% метоксильных групп; такая метилцеллюлоза нерастворима в воде.
В качестве исходного сырья применяется хлопковая или древесная целлюлоза. Метилирование ведут в автоклаве при давлении 0,98 – 1,18 МН/м 2 (10 – 12 кгс/см 2) и 125 -140 0 С. Затем продукт осаждают водой, промывают, отжимают и сушат.
Водорастворимая метилцеллюлоза применяется в качестве клеящего и как пенообразователь и эмульгатор в ряде отраслей промышленности, например в фармацевтической, лакокрасочной, бумажной, пищевой. Наибольшее техническое применение имеют водные растворы метилцеллюлозы.
1.4 Этилцеллюлоза
Этилцеллюлоза представляет собой простой эфир целлюлозы и этилового спирта; получается действием хлористого этила на щелочную целлюлозу в присутствии едкого натра :
[С 6 Н 7 О 2 (ОН) 3 ] n +3nNаОН+3nС 2 Н 5 Сl→[С 6 Н 7 О 2 (ОС 2 Н 5) 3 ] n +
3nNaСl+3nН 2 О
При алкилировании протекает побочный процесс гидролиза хлористого этила:
3С 2 Н 5 Сl+3NаОН→(С 2 Н 5) 2 О+ С 2 Н 5 ОН+3NaСl+Н 2 О
Чем меньше конценрация щелочи, тем интенсивнее протекает гидролиз. Поэтому как при предварительной обработке (мерсеризации), так и при алкилировании применяют 50%-ный раствор едкого натра. Щелочь необходима и для нейтрализации образующейся при гидролизе соляной кислоты, которая может понижать вязкость эфира целлюлозы и вызывать коррозию аппаратуры.
Алкилирование целлюлозы протекает постепенно. Вторичные гидроксильные группы замещаются сравнительно легко, дальнейшее алкилирование протекает значительно труднее. Для получения высокоалкилированной этилцеллюлозы процесс проводят при 130 0 С в присутствии большого избытка хлористого этила (до 10 – 13 моль на 1 моль целлюлозы).
Дальнейшее повышение температуры этилирования не оказывает большого влияния на степень замещения продукта, но вызывает деструкцию этилцеллюлозы.
В промышленных условиях алкилирование проводят в среде бензола, в котором растворяется образующаяся этилцеллюлоза, что облегчает протекание процесса замещения. Наличие бензола в алкилирующей смеси улучшает отвод тепла и повышает модуль ванны.
Технологический процесс получения этилцеллюлозы состоит из следующих стадий: мерсеризация целлюлозы, алкилирование, осаждение, промыва и сушка.
Этилцеллюлоза представляет собой белый или желтоватый порошкообразный продукт плотностью 1140 кг/м 3 (1,14 г/см 3). Она хорошо растворима в бензоле, ацетоне, толуоле, метиленхлориде, но нерастворима в бензине и других нефтепродуктах. Набухает и частично растворяется в спиртах. С трудом воспламеняется и практически не горит. Имеет хорошую химическую и термическую стойкость, устойчива к действию холодных и горячих растворов кислот и щелочей, светостойка, не гниет, не плесневеет. Температура плавления этилцеллюлозы 165 – 185 0 С, температура дестукции – до 220 0 С, морозостойкость равна - 40 0 С и ниже. Этилцеллюлоза хорошо совмещается с пластификаторами, пленки из нее прочны и эластичны.
1.5 Карбоксиметилцеллюлоза
Карбоксиметилцеллюлозой обычно называют натриевую соль целлюлозогликолевой кислоты. Это порошкообразный или волокнистый продукт белого или кремового цвета с насыпной плотностью 400 – 800 кг/м3. Применяемая в промышленности карбоксиметилцеллюлоза имеет степень замещения 0,4 – 1,4 и степень полимеризации 200 – 3000.
Карбоксиметилцеллюлоза растворяется в воде, 50%-ном водном этаноле, 40%-ном водном ацетоне; в других органических растворителях не растворяется. Продукт со степенью замещения ниже 0,4 растворяется в водных растворах щелочей. Карбоксиметилцеллюлоза совмещается с водорастворимыми смолами, например с гуммиарабиком, козеином, крахмалом, желатином, пектином, а также с глицерином, некоторыми гликолями и их производными.
Важным свойством карбоксиметилцеллюлозы является способность образовывать высоковязкие водные растворы при перемешивании сухого порошка в воде; вязкость растворов можно изменять в широких пределах.
В водных растворах карбоксиметилцеллюлоза является полиэликтролитом и проявляет свойства защитных коллоидов; она имеет также высокую биологическую устойчивость.
Карбоксиметилцеллюлоза является широко применяющимся водорастворимым производным целлюлозы. К наиболее важным областям применения относятся нефтедобывающая и горнообогатительная промышленность, в которых она используется как защитный коллоид в глинистых растворах при бурении скважин и как флотационный агент. Крупными потребителями карбоксиметилцеллюлозы являются химическая (производство моющих синтетических средств) и текстильная (шлихтование и аппретирование, загуститель печатных паст) промышленность. В бумажной промышленности карбоксиметилцеллюлоза используется как клеящая основа паст для обоев, в керамической – как суспендирующий агент и связующее.
Карбоксиметилцеллюлозу получают как периодическим, так и непрерывным способами.
1.6 Оксиэтилцеллюлоза
Оксиэтилцеллюлоза представляет собой продукт взаимодействия окиси этилена с целлюлозой. Это порошкообразное или волокнистое вещество без вкуса и запаха, растворимое в 2 – 10%-ном растворе едкого натра и 40%-ном растворе карбамида. Она нерастворима в воде и органических растворителях. Оксиэтилцеллюлоза некоторых марок растворима в воде, смесях этанол – вода, 90%-ной муравьиной кислоте.
Щелочерастворимая оксиэтилцеллюлоза может использоваться в текстильной промышленности в качестве добавок, улучшающих окрашиваемость волокн, как аппрет, шлихта. Добавка продукта к бумажной массе повышает прочность бумаги в мокром состоянии.
Водорастворимая оксиэтилцеллюлоза употребляется в качестве загустителя для латексных красок. Продукт используется также для эмульсионной полимеризации винилацетата. В текстильной промышленности – это высококачественная шлихта, носитель пигмента в красящих пастах, в ряде других отраслей промышленности она применяется в качестве защитного коллоида в гальванопластике. Как связующее в производстве керамики и стеклянных изделий, в литейном производстве.
1.7 Свойства простых эфиров целлюлозы
Свойства простых эфиров целлюлозы, в том числе растворимость, а следовательно и область применения, зависят: от характера и размера вводимого в целлюлозу радикала; от степени замещения и распределения введенных радикалов; от степени полимеризации и полидисперсности. С увеличением размера алкильного радикала уменьшается интенсивность межмолекулярного взаимодействия, понижаются гидрофильность и температура размягчения простых эфиров целлюлозы и прочность изделий из них.
Трехзамещенные простые эфиры целлюлозы с гидрофобными заместителями нерастворимы ни в водных системах, ни в распространенных органических растворителях. Частичное замещение приводит к расщеплению внутри- и межмолекулярных связей и разрушению кристаллической решетки в целлюлозе. Алкилцеллюлозы с низкой степнью замещения (от 40 до 70) растворимы в разбавленных водных растворах NaОН и набухают в воде, а при более высокой степени замещения (от 100 до180) уже растворяются в холодной воде. При дальнейшем повышении степени замещения растворимость в воде утрачивается, но появляется способность растворяться в полярных органических растворителях (пиридин, этанол), а затем и в менее полярных и неполярных (хлороформ, бензол). Максимальная растворимость в органических растворителях наблюдается обычно при значениях y от 220 до 260. Такие продукты растворяются также в ацетоне и ацетатных растворителях. При более высоких степенях замещения растворимость в полярных растворителях уже отсутствует, может наблюдаться лишь растворимость в некоторых неполярных растворителях.
Гидрофильные заместители (гидроксиалкины и карбоксиалкины) способствуют растворению простых эфиров в воде. При этом растворимость в воде обнаруживается при более низкой степени замещения, чем у алкилцеллюлоз с углеводородными заместителями. И сохраняется вплоть до трехзамещенных продуктов.
Следует отметить, что водные растворы гидроксиэтилцеллюлоз и натриевой соли карбоксиметилцеллюлозы не застудневают. Растворы же метил- и этилцеллюлозы в холодной воде при нагревании претерпевают желатинирования (образование геля) или фиокуляцию (образование хлопьев). Желатинирование метил- и этилцеллюлозы (соответственно, при 45…65 0 С и около 30 0 С) обратимо, а при охлаждении алкилцеллюлозы снова растворяютя.
Водорастворимые алкилированные целлюлозы используют в качестве эмультаторов, диспертаторов, пластифицирующих добавок, стабилизаторов, вводимых в различные водные дисперсии (пасты, краски, пищевые продукты, фармацевтические и косметические средства, растворы для бурения, строительные и керамические материалы и так далее). Эфиры с различной степенью алкилирования находят применение в бумажной промышленности в качестве клеев.
Простые эфиры целлюлозы с более высокими степенями замещения применяются как термопластичные материалы для изгатовления пластмасс, а также в качестве основы для лаков и для производства пленок. С увеличением степени замещения температура размягчения алкилцеллюлоз сначала понижается, достигая минимума при значениях y около 200…240, затем снова несколько повышается.
2. Способы получения простых эфиров целлюлозы
Простые эфиры целлюлозы получают методами О-алкилирование целлюлозы, активированной набуханием в щелочи (мерсеризацией). Методы алкилирования можно разделить на три группы: алкилирование с расходом щелочи действием алкилгалогенидов и алкилсульфатов; алкилирование без расхода щелочи с помощью реакций присоединения циклических и ненасыщенных соединений; алкилирование без расхода щелочи при действии гидроксиметильных соединений.
Алкилирование без расходов гидроксида Nа :
При акилировании целлюлозы алкилгалогенидами гидроксид натрия расходуется на связывание выделяющейся соляной кислоты. При алкилировании без расхода гидроксида натрия мерсеризация исходной целлюлозы также необходима для ее активации. В способах без расхода щелочи в качестве алкилирующих агентов используют либо гетероциклические соединения, содержащие непрочные циклы (оксиды, сульфиды), либо некоторые непредельные соединения, содержащие электроноакцепторные заместители.
В результате алкилирования оксидами, иминами и сульфидами получаются алкилцеллюлозы, содержащие в алкильном радикале, соответственно ОН-, NН- группы, например
R целл -ОН+Н 2 С-СНR→ R целл -О-СН 2 -СН-R
Примером алкилирования целллюлозы соединенным с непрочным с четырехчленным циклом служит реакция получения карбоксиэтилцеллюлозы действием ß-прониолактона:
R целл -О-Н+ СН 2 - СН 2 -СО→ R целл -О- СН 2 - СН 2 -СООNа
В данном случае на образование соли с карбоксильной группой расходуется щелочь. Одновременно протекает реакция образования сложного эфира гидроксикислоты.
Простые эфиры, содержащие в алкильном радикале реакционноспособные функциональные группы, могут использоваться для дальнейшего модифицирования целлюлозы. При действии на целлюлозу бифункциональных алкилирующих соединений может происходить обрывание цепей.
Алкилирование целлюлозы оксидами алкенов в щелочной среде происходит по механизму реакции присоединения. Целлюлозный анион как нуклеофил присоединяется к углеродному атому оксида:
R целл -ОН→ R целл -О
R целл -О+Н 2 С-СНR→ R целл -О-СН 2 -СН-R→ R целл -О- СН 2 -СН-R
Подобным образом, по-видимому, идет и алкилирование целлюлозы циклическими иминами и сульфидами, но, возможно, трехчленный цикл сначала превращается в непредельное соединение.
Непредельные соединения, содержащие электроноакцепторные заместители, алкилируют целлюлозу благодаря поляризации двойной связи. Щелочь, как и в предыдущем случае, оказывает каталитическое действие. Целлюлозный анион вступает в реакцию нуклеофильного присоединения:
R целл -О+Н 2 С= СН-R →R целл -О- СН 2 -СН-R→ R целл -О- СН 2 - СН 2 -R,
Где R – электроноакцепторная группа (-СN, -СОNН 2 , -SО 2 R I).
2.1 Применение простых эфиров целлюлозы
Этилцеллюлоза применяется для изоляции кабелей и проводов, изготовления радиодеталей и кондесаторов, защитных типографских покрытий, литьевых и прессовочных материалов (этролов), лаков, пленок и паст, используется для покрытия упаковочной бумаги, при изготовлении искусственной кожи, клеев для отделки мебели, для консервации металлических деталей в качестве съемного покрытия, наносимого из расплава.
Метилцеллюлоза находит разнообразное применение в различных областях промышленности: в текстильной (для шлихтовки), бумажной (для склеивания и мелования бумаги), косметической, фармацевтической, пищевой, в сельском хозяйстве.
Карбоксиметилцеллюлоза применяется в тестильной промышленности (для щлихтования нитей и тканей, в качестве загустителя красок), в нефтяной промышленности (для стабилизации глинистых суспензий, используемых при бурении нефтяных и газовых скважин), в горнообогатительной промышленности (при флотационном обогащении медно-никелевых и других руд). Очищенная карбоксиметилцеллюлоза употребляется в производстве клеев, зубных паст, кинофотоматериалов, в фармацевтической промышленности.
Оксиэтилцеллюлоза используется главным образом как загуститель при изготовлении красок, фотоэмульсий и фотобумаги, как эмульгатор в производстве ПВХ, ПВА и других полимеров. Находит применение в текстильной, косметической, электротехнической и керамической промышленности, а также при изготовлении бумаги, клеев, паст, чернил. Пленки из оксиэтилцеллюлозы имеют хорошие механические свойства: разрушающие напряжение при растяжении 27 – 28 Мпа, относительное удлинение 14 – 40%.
Бензилцеллюлоза применяется в основном для изготовления кабелей. Благодаря хорошей адгезионной способности бензилцеллюлоза широко используется для изготовления защитных покрытий и лаков. Растворы бензилцеллюлозы применяютсядля получения ""вечных"" обоев и декоративной моющейся бумаги, из нее получают также прессовочные и литьевые композиции для производства водо - и щелочестойких изделий.
3 Производство простых эфиров целлюлозы
Простые эфиры целлюлозы подразделяются на растворимые в органических растворителях и растворимые в воде или разбавленных щелочах. Существует много способов их получения, но каждый из них начинается с получением щелочной целлюлозы (алкалицеллюлозы).
Щелочную целлюлозу можно готовить периодическим (более распространен) и непрерывным методами. Целлюлозу в виде листов выдерживают в вертикальном положении при 20 0 С в ванне листы отжимают в течение 20 минут от избытка щелочи при давлении до 16 Мпа. Отжатые листы, масса которых в 2,5 – 2,8 раза превышает массу исходных листов, представляют щелочную целлюлозу, в которой щелочь связана с гидроксильными группами в виде аддитивного соединения –ОН*NаОН и алкоголята –ОNа.
Набухшие и отжатые листы щелочной целлюлозы затем измельчают в аппаратах-измельчителях периодического действия, снабженных Z-образными мешалками и ножами, которые укреплены на лопастях мешалок и днище. Через 40 – 60 минут измельчения при периодическом переключении лопастей мешалок (на размол и перемешивание) образуется порошок с насыпной плотностью 180 – 300 кг/м 3 в зависимости от щелочности. Перед этерификацией для увеличения производительности оборудования порошок уплотняют до 280 – 300 кг/м 3 прижимными валками на транспортере и загружают в бункер или реактор.
3.1 Производство этилцеллюлозы
Этилцеллюлозу получают взаимодействием щелочной хлопковой или сульфитной целлюлозы с хлористым этилом :
[-С 6 Н 7 О 2 (ОН) 3 -] n +3nС 2 Н 5 Сl+3nNаОН→[-С 6 Н 7 О 2 (ОС 2 Н 5) 3 -] n +
3nNaСl+3nН 2 О
При алкилировании, кроме основной реакции, протекает побочный процесс гидролиза хлористого этила:
3С 2 Н 5 Сl+3NаОН→(С 2 Н 5) 2 О+ С 2 Н 5 ОН+3NaСl+Н 2 О
С целью уменьшения процесса гидролиза как при изготовлении щелочной целлюлозы, так и при алкилировании применяют 50%-ный раствор едкого натра. Кроме того, избыток щелочи необходим и для нейтрализации образующейся при гидролизе соляной кислоты. Первичные гидроксильные группы целлюлозы замещаются на алкильные сравнительно легко, но дальнейшая реакция проходит значительнее труднее. Поэтому реакцию проводят при 130 0 С в присутствии большого избытка хлористого этила (10 – 13 моль на 1 моль целлюлозы) в гомогенных (в бензоле) и гетерогенных условиях.
Технологический процесс производства этилцеллюлозы гомогенным способом состоит из следующих стадий: мерсеризация целлюлозы, алкилирование щелочной целлюлозы, осаждение этилцеллюлозы, ее промывка и сушка.
Древесную целлюлозу разрыхляют на трепальной машине 1 и подают в смеситель 2 с Z-образными мешалками, в котором она обрабатывается 50%-ным раствором едкого натра при 20 – 30 0 С и модуле ванны 1: 3 в течение 3 часов. Полученную щелочную целлюлозу (алкалицеллюлозу) загружают в реактор-автоклав 4,снабженный рубашкой и якорной мешалкой. В реактор загружают также этилирующую смесь из мерника 5 и твердый едкий натр, чтобы в процессе этирификации его концентрация оставалась постоянной. Для подогрева реакционной массы до 80 0 С (начало реакции) в рубашку реактора подают пар.
Алкилирование проводят при 130 0 С и давлении 1,28 – 1,57 МН/м 2 (13 – 16 кгс/см 2) в течение 10 – 12 часов. Образующийся сироп (раствор этилцеллюлозы) выгружают в осадитель 6 и подают туда воду до достижения модуля ванны 1: 20. Осаждение этилцеллюлозы происходит при 84 – 100 0 С в течение 1 часа. При этом легколетучие жидкости (эфир, спир, бензол и хлористый этил) отгоняются и конденсируются в холодильниках 7, 8. Конденсат разделяют в отстойнике 9 и верхний слой направляют в емкость 10, а нижний – в емкость 11. Этилцеллюлозу после осаждения вместе со щелочно-солевым раствором струей воды в нутч-фильтр 12 для для промывки. Крупные куски продукта измельчаются в мельнице 13. Этилцеллюлозу отмывают от хлористого натра водой при модуле 1: 12 и температуре 60 - 65 0 С. После промывки суспензия поступает при перемешивании в мутильник 14, а затем центрифугу 15. Отжатый маточный раствор проходит через ловушку 16 в систему очистки сточных вод. Из центрифуги этилцеллюлоза с влажностью около 50% поступает на сушку в гребковые вакуумные сушилки 17.
Сушку проводят при 105 0 С и остаточном давлении 27кН/м 2 (200 мм рт. ст). Влажность продукта не должна превышать3%.
Алкилирование проводят при 110 - 130 0 С и давлении 1,3 – 1,6 МПа в течении 10 – 12 часов. Затем реакционную массу охлаждают до 70 0 С и образующийся раствор этилцеллюлозы выгружают в осадитель 2, в который залита холодная вода до достижения модуля ванны 1: 20. Осаждение заканчивается выдержкой при 98 - 100 0 С в течение 1 часа. При этом летучие жидкости (эфир, спирт, бензол и хлористый этил) отгоняются и конденсируются в холодильнике 3. Конденсат собирают в отстойнике и разделяют: верхний слой направляют в один сборник, а нижний – в другой. Суспензию этилцеллюлозы в воде, содержащей щелочь и соль, подают в нутч-фильтр 4 для разделения. Затем ее вновь заливают водой, нейтрализуют 0,2%-ным растворм соляной кислоты при 80 - 90 0 С, отбеливают 0,5%-ным растворм перманганата калия при 20 0 С, промывают водой и стабилизируют 0,2%-ным растворм едкого натра при 50 0 С. Стабилизированная этилцеллюлоза дополнительно промывается горячей водой для удаления остатка щелочи и соли. После отжима на центрифуге 5 этилцеллюлоза с влажностью 45 – 60% поступает в бункер 6, откуда пневмотранспортом или шнеком подается в сушилку 7. Сушка осуществляется в вакуум-сушильных агрегатах с перемешивающими лопастями при 80 0 С (0,03 – 0,04 МПа) в течение 5 -7 часов до остаточной влажности примерно 2%.
После сушки этилцеллюлозу просеивают и отделяют частицы диаметром более 4 мм, которые подвергают размолу.
3.2 Производство метилцеллюлозы
Метилцеллюлоза – водорастворимый полимер, содержащий 26 – 33% метоксильных групп ОСН 3 (степень замещения 1,5 –2,0). Получают ее взаимодействием щелочной целлюлозы с хлористым метилом по реакции :
[-С 6 Н 7 О 2 (ОН) 3 -] n +2nCН 3 Сl+2nNаОН→[-С 6 Н 7 О 2 (СОН 3) 2 ОН-] n +
2nNaСl+2n Н 2 О
Хлористый метил при взаимодействии со щелочью образуют диметиловый эфир и метиловый спирт, являющиеся побочными продуктами в данном процессе.
Метилцеллюлозу чаще всего получают на основе сульфитной целлюлозы по схеме, аналогичной производству этилцеллюлозы. На 1 моль щелочной целлюлозы берут 8 моль хлористого метила (бензол не применяют). Реакцию проводят при 65 – 80 0 С в течении 6 – 7 часов. После окончания реакции отгоняют летучие продукты, оставшуюся щелочь нейтрализуют 5%-ной фосфорной кислотой при 90 0 С и промывают метилцеллюлозу водой с температурой не ниже 90 0 С. После отделения жидкой фазы метилцеллюлоза поступает на сушку в вакуум-сушилку, где при 90 0 С (0,04 МПа) высушивается до остаточной влажности около 5% за 6 часов.
Получение метилцеллюлозы может быть осуществлено по схеме с циркуляцией хлористого метила, особенностью которой является уменьшение расхода хлористого метила на побочные реакции.
3.3 Производство карбоксиметилцеллюлозы
Карбоксиметилцеллюлоза – простой эфир целлюлозы и гликолевой кислоты. Получают ее при взаимодействии щелочной целлюлозы с монохлоруксусной кислотой или ее натриевой солью по реакции :
[-С 6 Н 7 О 2 (ОН) 3 -] n +nClСН 2 СООNа+nNаОН→
[-С 6 Н 7 О 2 (ОСН 2 СООNа)(ОН) 2 +nNаСl+nН 2 О
Одновремено с основной реакцией протекает побочная реакция гидролиза монохлорацетата натрия до натриевой соли гликолевой кислоты. На практике получают натриевую соль карбоксиметилцеллюлозы со степенью замещения 0,4 – 1,0 периодическим или непрерывным методом.
Получение карбоксиметилцеллюлозы происходит в гетерогенных условиях при обработке щелочной целлюлозы монохлорацетатом натрия в присутствии небольшого количества воды. Все компоненты тщательно перемешивают и перетирают в лопастных смесителях периодического действия в течение 1,5 – 2,5 часа при 20 0 С. При этом происходит карбоксиметилирования целллюзы. Затем натриевую соль карбоксиметилцеллюлозы сушат воздухом в течение 2 – 3 минут при 90 - 120 0 С и измельчают на молотковых мельницах. Технический продукт содержит в качестве примесей хлорид, гидрат окиси и гликолят натрия. Примеси удаляют экстракцией этиловым спиртом. Очишенную натриевую соль карбоксиметилцеллюлозы отжимают в гидравлическом прессе под давлением 2 МПа, разрыхляют и сушат воздухом при 65 – 70 0 С.
3.4 Производство оксиэтилцеллюлозы
Оксиэтилцеллюлоза – продукт реакции щелочной целлюлозы с окисью этилена:
[-С 6 Н 7 О 2 (ОН) 3 -] n +nН 2 С-СН 2 + nNаОН→
→[-С 6 Н 7 О 2 (ОСН 2 СН 2 ОН)(ОН) 2 -] 2 +nNаСl+nН 2 О
Окись этилена реагирует как с гидроксильными группами целлюлозы, так и с первичной гидроксильной группой оксиэтилцеллюлозы. Таким образом, в отличие от других производных целлюлозы, оксиэтилцеллюлоза характеризуется не только степенью замещения гидроксильных групп в элементарном звене (она составляет 0,7 – 1,0), но и числом молей окиси, присоединенной к первичному гидроксилу уже образовавшейся оксиэтилцеллюлозы (оно составляет 2,0 – 2,8). Поэтому строение оксиэтилцеллюлозы может быть представлено следующим образом:
[-С 6 Н 7 О 2 (ОСН 2 СН 2 ОСН 2 СН 2 ОН)(ОН) 2 -] n
При синтезе оксиэтилцеллюлозы протекают побочные реакции образования этиленгликоля, ди- и триэтиленгликоля.
Оксиэтилирование щелочной целлюлозы проводят в вертикальном шнековом аппарате планетарного типа. В верхнюю часть аппарата подают целлюлозу и окись этилена. Температура поддерживается в пределах 20 0 С (верх) и 40 0 С (низ), вакуум 0,01 МПа. На 1 моль целлюлозы вводится 1,5 – 2 моль окиси этилена. Время нахождения массы в аппарате 4,5 – 5 часов. Оксиэтилцеллюлозу, выходящую из аппарата, охлаждают до 20 0 С, нейтрализуют 20%-ным раствором уксусной кислоты в ацетоне до рН 6 – 7, отжимают в прессе через капроновую ткань под давлением 4 Мпа и экстрагируют смесью метилового спирта с ацетоном (1:1) при модуле ванны 1:10, отделяя полиэтиленгликоли и ацетат натра. Сушка оксиэтилцеллюлозы проводится в вакуум-сушилках при перемешивании в течение 4 часов при 60 0 С (0,02 МПа).
4. Новые направления получения и использования простых эфиров целлюлозы
В последнее время все большее значение приобретают смешанные простые эфиры целлюлозы. Они могут содержать либо две разных алкильных группы (например, этилметилцеллюлозы), либо наряду с алкильной гидроксиалкильную (метилгидроксиэтилцеллюлоза), карбоксильную или ту и другую (карбоксиметилгидроксиэтилцеллюлоза) группы. Кроме того, известны смешанные эфиры целлюлозы, содержащие одновременно простые эфирные и сложноэфирные группы (например, фталингидроксипропилметилцеллюлоза).
Свойства смешанных простых эфиров целлюлозы, в том числе растворимость, зависят от вида и массовой доли введенных заместителей и могут обеспечить смешанному эфиру специфическое применение, в том числе использование подобных эфиров с низкой степенью замещения для модифицирования целлюлозы. Перспективное направление - получение функциональных производных целлюлозы. Так, благодаря пористой структуре функциональных производных их можно использовать для получения ионообменных материалов, применяемых в колоночной хромотографии. Эти производные получают в волокнистой, порошковой или гранулированной формах введением алкильных заместителей, содержащих аминогруппы (для анионообменников) и сульфогруппы (для катионообменников), напрмер, аминопропилцеллюлоза R целл -О-СН 2 СН 2 СН 2 NН 2 , сульфоэтилцеллюлоза R целл -О-СН 2 СН 2 SО 3 Н и другие. Синтезированные сульфоловые производные целлюлозы – простые эфиры типа R целл -О-СН 2 СН 2 SО 2 R, где R – остатки –С 6 Н 4 NН 2 , -СН 3 (ОН)NН 2 , -С 6 Н 3 (ОН)СООН. Последний эфир имеет хелатообразующие свойства и может улавливать из растворов ионы металлов.
Взаимодействием хлорангидрида целлюлозогликолевой кислоты с антибиотиками (эритромицином) получают бактерицидные производные целлюлозы. Хлорангидрид целлюлозогликолевой кислоты может также использоваться для иммобилизации ферментов в результате взаимодействия с его аминогруппами. Простые эфиры, содержащие аминогруппы, могут взаимодействовать с карбоксильными группами ферментов.
Многие смешанные простые эфиры целлюлозы (например, этилгидроксиэтилцеллюлоза, трехзамещенная трибензилметилцеллюлоза и другие) в органических растворителях образуют концентрированные анизотропные растворы со свойствами жидких кристаллов.
Таким образом, получение новых производных целлюлозы, в том числе разнообразных смешанных простых эфиров целлюлозы со специфическими свойствами, является весьма перстпективной областью химии целлюлозы.
Основные направления использования: производство искуственных волокн, эфироцеллюлозных пластмасс, различных пленок, полупроницаемых мембран, лакокрасочных материалов. Пленки применяются главным образом в качестве упаковочного материала для пищевых продуктов, товаров широкого потребления, жидких и сыпучих химических и нефтехимических продуктов, для бытовых целей. Для изготовления упаковочных плёнок используют целлюлозу и её эфиры.
4.1 Смешанные простые эфиры целлюлозы
Алкилпроизводные целлюлозы получаются так же, как и этилцеллюлоза, - действием алкилирующего агента на щелочную целлюлозу при нагревании. С увеличением длины углеродной цепи в алкилирующем агенте, обычно в галогеналкиле, реакционная способность галогена снижаетя, и скорость процесса уменьшается.
Пропилцеллюлоза может быть получена обработкой щелочной целлюлозы нормальным пропилхлоридом при 130 0 С. Она растворима в бензоле и спиртобензольной смеси, мало растворима в спирте, уступает этилцеллюлозе по механической прочности и пластичности, но превосходит ее по водостойкости. Технического интереса пропилцеллюлоза не представляет.
Бутилцеллюлоза получается обработкой щелочной целлюлозы хлористым бутилом при повышенной температуре и давлении. Она щелоче- и кислотостойка, водостойка, но имеет плохие механические свойства, поэтому непосредственно в технике не применяется, а используется для получения смешанного простого эфира этилбутилцеллюлозы.
Алкилирование целлюлозы галогенамилом и галогенгексилом протекает гораздо труднее, чем в первых двух случаях. Гексилцеллюлоза обладает большой водостойкостью, но низкими механическими показателями.
Аллилцеллюлозу получают действием на щелочную целлюлозу 20-кратного избытка бромистого аллила.
Смешанные эфиры целюлозы получают действием на целлюлозу одновременно двух или нескольких галогеналкилов или ступенчатым алкилированием щелочной целлюлозы. Введением в глюкозный остаток различных радикалов достигается сочетание оптимальных свойств соответствующих индивидуальных эфиров.
Техническое значение имеет этилбутилцеллюлоза, в которой содержится примерно 0,5 бутильной группы на единицу С 6 Н 10 О 5 . Введение
в эитлцеллюлозу бутильных групп заметно повышает ее водостойкость, почти не ухудшая механических свойств эфира.
целлюлоза производство эфир
4.2 Экологический аспект
Для производства целлюлозы эфиров используют облагороженную хлопковую и древесную (сульфатную и сульфитную) целлюлозу. Хлопок представляет собой почти чистую целлюлозу и не требует сложной обработки, чтобы стать исходным материалом для изготовления искусственного волокна и неволокнистых пластиков.
И вискозное волокно, и целлофан – это регенерированная (из раствора) целлюлоза. Очищенная природная целлюлоза обрабатывается избытком концентрированного гидроксида натрия.
Едкая щелочь – сильное химическое основание, применяемое в целлюлозно-бумажной промышленности для делигнификации целлюлозы, в производстве бумаги, картона, искусственных волокн. Гидроксид натрия - едкое и коррозионноактивное вещество. Оно относится к веществам второго класса опасности. Поэтому при работе с ним требуется соблюдать осторожность. При попадании на кожу, слизистые оболочки и в глаза образуются серьёзные химические ожоги. При контакте слизистых поверхностей с едкой щёлочью необходимо промыть поражённый участок струей воды, а при попадании на кожу слабым раствором уксусной кислоты. При работе с едким натрием рекомендуется следующие защитные средства: химические брызгозащитные очки для защиты глаз, резиновые перчатки или перчатки с прорезиненной поверхностью для защиты рук, для защиты тела, химически-стойкая одежда пропитанная винилом или прорезиненные костюмы. Технический едкий натр пожаро- и взрывобезопасен.
Простые эфиры целлюлозы являются перспективными экологически безопасными тароупаковочными материалами.
Заключение
Простые эфиры целлюлозы в настоящее время приобрели большое практическое значение. Простые эфиры целлюлозы имеют ряд ценных свойств: высокую химическую стойкость, легко растворимы, малогорючи, трудновоспламенимы, морозостойки и хорошо совмещаются с пластификаторами. Некоторые простые эфиры целлюлозы при определенной степени замещения могут растворяться не только в органических растворителях, но и в разбавленных водных растворах щелочи и даже в холодной воде. Все эти свойства играют важную роль в их применении в упаковочной отрасли.
Материалы на основе эфиров целлюлозы используют в виде наружного слоя многослойных материалов (ламинатов) в качестве износостойкого покрытия. Из рулонных материалов на основе простых эфиров целлюлозы получают тару различных типоразмеров, пригодную для упаковки широкого ассортимента пищевых продуктов (высокожирные, сухие, плодоовощные, замороженные, кондитерские изделия, мед, джемы и т.п.).
Простые эфиры целлюлозы являются экологически безопасными, что делает их довольно перспективными материалами в упаковочной отрасли.
Список литературы:
1. Азаров В.И., Буров А.В., Оболенская А.В. Химия древисины и синтетических полимеров. СПб., 1998. 618 с.
2. Никитин В.Н., Оболенская А.В., Щеголев В.П. Химия древисины и целлюлозы. М.: Лесн. Пром-сть, 1978. 368 с.
3. Леонович А.А., Оболенская А.В. Химия древисины и полимеров. М.: Лесн. Пром-сть, 1988. 152 с.
4. Роговин З.А. Основы химии и технологии химических волокон. М.: Химия, 1974. Т. 1-2.
5. Роговин З.А. Химия целлюлозы. М.: Химия, 1972. 519 с.
6. Роговин З.А. Химические превращения и модификация целлюлозы. М.: Химия. 1987. 173 с.